Через генетический аппарат гормон
Механизмы действия гормонов
Ответ клетки-мишени на действие гормона формируется созданием гормонрецепторного (ГР) комплекса, что приводит к активации самого рецептора, инициации ответа клетки. Гормон адреналин при взаимодействии с рецептором открывает мебранная каналы, a Na + — входной ионный ток обусловливает функцию клетки. Однако большинство гормонов открывают или закрывают мембранные каналы не самостоятельно, а во взаимодействии с G-белком.
Механизм действия гормонов на клетки-мишени связан с их химическим строением:
■ водорастворимые гормоны — белки и полипептиды, а также производные аминокислоты — катехоламины, взаимодействуют с рецепторами мембраны клетки-мишени, образуя комплекс «гормон — рецептор» (ГР). Возникновение этого комплекса приводит к образованию вторичного или внутриклеточного посредника (мессенджера), с которым связаны изменения функции клетки. Количество рецепторов на поверхности мембраны клетки-мишени составляет примерно 104-105;
■ жирорастворимые гормоны — стероидные — проходят сквозь мембрану клетки-мишени и взаимодействуют с плазматическими рецепторами, количество которых колеблется от 3000 до 104, образуя комплекс ГР, который далее поступает к мембране ядра. Стероидные гормоны и производные аминокислоты тирозина — тироксин и трийодтиронин — проникают через ядерную мембрану и взаимодействуют с ядерными рецепторами, соединенными с одной или более хромосом, следствием чего являются изменения синтеза белка в клетке-мишени.
Согласно современным представлениям, действие гормонов обусловлена стимуляцией или угнетением каталитической функции некоторых ферментов в клетках-мишенях. Этот эффект может достигаться двумя путями:
■ взаимодействием гормона с рецепторами поверхности клеточной мембраны и запуска цепи биохимических превращений в мембране и цитоплазме;
■ проникновением гормона через мембрану и связывания с рецепторами цитоплазмы, после чего гормонрецепторний комплекс проникает в ядро и органеллы клетки, где и реализует свой регуляторный эффект путем синтеза новых ферментов.
Первый путь приводит к активации мембранных ферментов и образования вторичных мессенджеров. На сегодня известно четыре системы вторичных мессенджеров:
■ кальмодулин — ионизированный Са 2+.
Второй путь влияния на клетки-мишени — комплексирования гормона с рецепторами, которые содержатся в ядре клетки, ведет к активации или торможения ее генетического аппарата.
Мембранные рецепторы и вторичные посредники (мессенджеры)
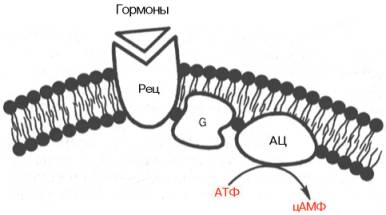
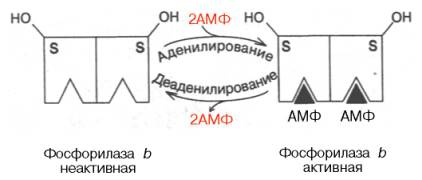
Гормоны, связываясь с рецепторами мембраны клетки-мишени, образуют комплекс «гормон — рецептор» ГР (шаг 1) (рис. 6.3). Конформационные изменения рецептора активируют стимулирующий G-белок (объединенный с рецептором), который представляет собой комплекс из трех субъединиц (α-, β-, γ-) и гуанозиндифосфат (ГДФ). замена
ТАБЛИЦА 6.11. Краткая характеристика гормонов
Где продуцируются гормоны
Стимулирует продукцию аденогипофизом тиреотропину
Стимулирует продукцию аденогипофизом АКТГ
Стимулирует продукцию аденогипофизом лютеинизирующего (ЛГ) и фолликулостимулирующего (ФСП гормонов
Рилизинг-фактор гормона роста
Стимулирует продукцию аденогипофизом соматотропина — гормона роста
Подавляет продукцию аденогипофизом гормона роста
Пролактин-ингибирующий фактор (допамин)
Подавляет продукцию аденогипофизом пролактина
Стимулирует продукцию аденогипофизом пролактина
Стимулирует выделение молока, сокращение матки
Вазопрессин — антидиуретический гормон
Стимулирует реабсорбцию воды в дистальном отделе нефрона
ТТГ, или тиреостимулирующие гормон
Стимулирует синтез и секрецию щитовидной железой тироксина, трийодтиронина
Стимулирует секрецию корой надпочечников глюкокортикоидов (кортизола)
Стимулирует рост фолликулов и секрецию эстрогенов яичниками
Стимулирует овуляцию, образование желтого тела, а также синтез эстрогенов и прогестерона яичниками
Гормон роста, или соматотропный гормон
Стимулирует синтез белка и рост в целом
Стимулирует продукцию и секрецию молока
Промежуточная доля гипофиза
Стимулирует синтез меланина у рыб, амфибий, рептилий (у людей стимулирует рост скелета (оссификация костей), увеличивает интенсивность метаболизма, теплопродукции, увеличивает утилизацию клетками белков, жиров, углеводов, стимулирует становление умственных функций после рождения ребенка
Кора надпочечников (сетчатая зона)
Стимулируют продукцию дигидрогепиандростерону и андростендиона
Кора надпочечников (пучковая зона)
Стимулирует глюконеогенез, противовоспалительное действие, подавляет иммунную систему
Кора надпочечников (клубочковая зона)
Увеличивает реабсорбцию ионов Na +, секрецию ионов К + в канальцах нефрона
Активация альфа-, бета-адренорецепторов
Рост и развитие женских половых органов, пролиферативная фаза менструального цикла
Секреторная фаза менструального цикла
Сперматогенез, вторичные половые мужские признаки
Парат гормон (паратиреоидний гормон)
Увеличивает концентрацию ионов Са 2+ в крови (деминерализация костей)
Щитовидная железа (С-клетки)
Уменьшает концентрацию ионов Ca2 + в крови
Увеличивает всасывание в кишечнике ионов Са 2+
Поджелудочная железа — бета-клетки
Уменьшает концентрацию глюкозы в крови
Поджелудочная железа — альфа-клетки
Увеличивает концентрацию глюкозы в крови
Хориональний гонадотропин человека
Увеличивает синтез эстрогена и прогестерона
Плацентарный лактоген человека
Действует подобно гормона роста и пролактина во время беременности
РИС. 6.3. Схема механизма действия гормона с образованием вторичного внутриклеточного посредника цАМФ. ГДФ — гуаниндифосфат, ГТФ — гуанинтрифосфат
ГДФ на гуанозинтрифосфат ГТФ (шаг 2) приводит к отрыву α-субъединицы, которая тут же взаимодействует с другими сигнальными белками, изменяя активность ионных каналов или клеточных ферментов — аденилатциклазы или фосфолипазы С — и функцию клетки.
Действие гормонов на клетки-мишени с образованием вторичного посредника цАМФ
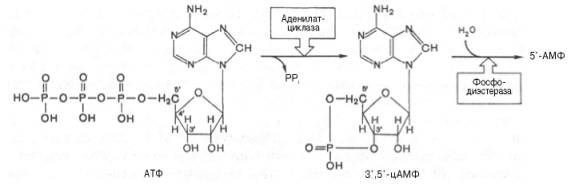
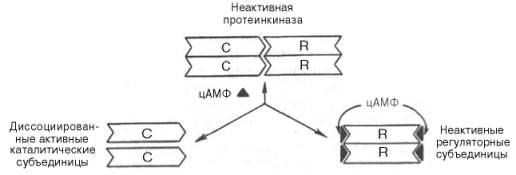
Активированный мембранный фермент аденилатциклаза превращает АТФ на вторичный посредник — циклического аденозинмонофосфата цАМФ (шаг 3) (см. Рис. 6.3), который в свою очередь активирует фермент протеин киназу А (шаг 4), что приводит к фосфорилирования специфических белков (шаг 5) , следствием чего является изменение физиологической функции (шаг 6), например, образование новых мембранных каналов для ионов кальция, что приводит к росту силы сердечных сокращений.
Вторичный посредник цАМФ распадается под воздействием фермента фосфодиэстеразы в неактивной формы 5′-АМФ.
Некоторые гормоны (натрийуретический) взаимодействуют с тормозными G-белками, что приводит к снижению активности мембранных ферментов аденилатциклазы, уменьшение функции клетки.
Действие гормонов на клетки-мишени с образованием вторичных посредников — диацилглицеролу и инозитол-3-фосфат
Гормон образует комплекс с рецептором мембраны — ОС (шаг 1) (рис. 6.4) и через G-белок (шаг 2) активирует фосфолипазу С, прикрепленную к внутренней поверхности рецептора (шаг 3).
Под влиянием фосфолипазы С, которая гидролизует мембранные фосфолипиды (фосфатидилинозитолбифосфат), образуются два вторичных посредников — диацилглицерол (ДГ) и инозитол-3-фосфат (ИФ3) (шаг 4).
Вторичный посредник ИФ3 мобилизует выход ионов Са 2+ из митохондрий и эндоплазматического ретикулума (шаг 5), которые ведут себя как вторичные посредники. Ионы Ca2 + вместе с ДГ (липидный вторичный посредник) активируют фермент протеинкиназа С (шаг 6), которая фосфорилирует белки и вызывает изменение физиологических функций клетки-мишени.
Действие гормонов с помощью систем «кальций — кальмодулин», который выступает в роли вторичного посредника. Кальций при проникновении в клетку связывается с кальмодулином и активирует его. Активированный кальмодулин, в свою очередь, повышает активность протеинкиназы, которая приводит к фосфорилирования белков, изменения функций клетки.
Действие гормонов на генетический аппарат клетки
Жирорастворимые стероидные гормоны проходят сквозь мембрану клетки-мишени (шаг 1) (рис. 6.5), где связываются с белками-рецепторами цитоплазмы. Образованный комплекс ГР (шаг 2) диффундирует в ядро и связывается со специфическими участками ДНК хромосомы (шаг 3), активируя процесс транскрипции путем образования мРНК (шаг 4). мРНК переносит матрицу в цитоплазму, где обеспечивает процессы трансляции на рибосомах (шаг 5), синтез новых белков (шаг 6), что приводит к изменению физиологических функций.
Жирорастворимые тиреоидные гормоны — тироксин и трийодтиронин — проникают в ядро, где связывается с белком-рецептором, который представляет собой протеины, которые находятся на хромосомах ДНК. Эти рецепторы контролируют функцию как промоутеров, так и операторов генов.
Гормоны активируют генетические механизмы, которые находятся в ядре, благодаря чему производится более 100 типов клеточных белков. Многие из них являются ферментами, которые повышают метаболическую активность клеток организма. Однократно прореагировав с внутриклеточными рецепторами, тиреоидные гормоны обеспечивают контроль экспрессии гена на несколько недель.
Действие гормонов через внутриклеточные рецепторы
Некоторые гормоны, такие как стероидные гормоны и гормоны щитовидной железы, по свойствам являются гидрофобными. В плазме крови для их транспортировки используются специальные белки-транспортеры. В комплексе с этими белками они не способны взаимодействовать с мембранными рецепторами, но способны отрываться от них и диффундировать через клеточную мембрану внутрь клетки. После перехода в цитозоль гормоны немедленно подхватываются другими белками, которые уже являются рецепторами.

1) гормон проходит через двойной липидный слой клеточной мембраны.
2)взаимодействие гормона с рецептором (R) приводит к изменению конформации рецептора и снижению сродства к белкам-шаперонам, отделяющимся от комплекса гормон-рецептор.
3) комплекс гормон-рецептор проходит в ядро, взаимодействует с регуляторной нуклеотидной последовательностью в ДНК — энхансером или сайленсером.
4) увеличивается (при взаимодействии с энхансером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полимеразы.
5) соответственно увеличивается или уменьшается скорость транскрипции структурных генов.
6) увеличивается или уменьшается скорость трансляции.
7) изменяется количество белков, которые могут влиять на метаболизм и функциональное состояние клетки. Таким образом, данные гормоны влияют на количество ферментов в клетке.
Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуются часы.
Рецепторы могут находиться внутри клетки, а также на клеточной мембране.
Механизм действия гормонов ч/з внутриклеточные регуляторы.Гормон проникает в клетку, связывается с рецептором. Образованный таким образом гормон-рецепторный комплекс перемещается в ядро и действует на генетический аппарат клетки. В результате меняется процесс транскрипции, а в дальнейшем, синтез белков. Таким образом, данные гормоны влияют на количество ферментов в клетке.Механизм действия гормонов через рецепторы плазматических мембран
В этом случае гормон не проникает в клетку, а взаимодействует с рецептором на поверхности мембраны. Далее возможны два варианта событий:
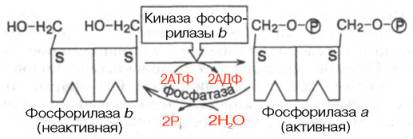
1.Первый вариант — с рецептором связан фермент, который из специфического субстрата образует второй посредник. Второй посредник далее связывается со своим рецептором в клетке. Чаще всего рецептором посредника является протеинкиназа, которая за счет фосфата АТФ, фосфорилирует белки. В результате изменяются их свойства, возникает биохимический и физиологический эффект.2.Второй вариант — рецептор связан не с ферментом мембраны, а с ионным каналом. При связывании гормона с рецептором, канал открывается, ион поступает в клетку и выполняет функции второго посредника.Хорошо изученными вторыми посредниками являются цик-лические нуклеотиды (цАМФ, цГМФ) и Са2+. Механизм действия гормонов через цАМФКогда соответствующий гормон связывается с рецептором, в мембране активируется фермент аденилатциклаза, который из АТф образует цАМФ. цАМФ является аллостерическим активатором протеинкиназы, которая фосфорилирует белки и изменяет их свойства. Например, фосфорилирование фосфорилазы приводит к повышению ее активности, а фосфорилирование глико-генсинтетазы — к снижению. цАМФ расщепляется до АМФ фос-фодиэстеразой.Содержание цАМФ в клетке увеличивают: глюкагон, катехо-ламины (через в-рецепторы), антидиуретический гормон, гиста-мин (Н2-рецепторы), простагландин-Е, простациклин, тиреотроп-ный гормон, АКТГ, холерный токсин.Содержание цАМФ в клетке снижают: ацетилхолин (М-холи-норецепторы), катехоламины (а2-рецепторы), соматостатин, ан-гиотензин-П, опиаты, коклюшный токсин.Функции цАМФ: Как второй посредник участвует в регуляции:проницаемости мембран;синтеза макромолекул;активности ферментов;процессов деления; в нейронах — увеличения возбудимости;в сердце — стимуляции;в гладких мышцах — расслабления;в железах — увеличения секреции;изменения иммунных реакций; дезагрегации тромбоцитов.
Механизм действия гормонов через Са2+ В невозбужденной клетке концентрация кальция 10″7М. При возбуждении концентрация кальция возрастает до 10″6-10
5М. Источниками кальция для этого являются: межклеточная жидкость (содержание кальция — 10-3М), эндоплазматический ретикулум (тоже содержание кальция — 103М).
Когда гормон связывается с рецептором, в мембране открывается кальциевый канал. В результате содержание кальция в клетке возрастает. Кальций связывается с белком клеток — каль-модулином, образуется комплекс, который может действовать непосредственно на белки, вызывая эффекты, или действовать на кальмодулин-зависимую протеинкиназу. Эта протеинкиназа фосфорилирует белки, в результате изменяются их свойства. Са2+ в качестве второго посредника выполняет те же функции, что и цАМФ, за исключением того, что в гладких мышцах вызывает сокращение, тромбоцитах — агрегацию.Содержание кальция в клетке повышают: катехоламины через а1-рецепторы, ацетилхолин через М-холинорецепторы, гистамин через Н1- рецепторы, тромбоксан, ангиотензин-II.
49. Инсулин. Строение, образование из проинсулина, метаболизм, регуляция секреции. Влияние на обмен веществ.
Строение: Представляет собой полипептид из 51 аминокислоты, массой 5,7 кД, состоящий из двух цепей А и В, связанных между собой дисульфидными мостиками.
Синтез: Синтезируется в клетках поджелудочной железы в виде проинсулина, в этом виде он упаковывается в секреторные гранулы и уже здесь образуется инсулин и С-пептид.
Регуляция синтеза и секреции: Активируют синтез и секрецию:
-глюкоза крови – главный регулятор, пороговая концентрация для секреции инсулина – 5,5 ммоль/л,
-жирные кислоты и аминокислоты,
-влияния n.vagus – находится под контролем гипоталамуса, активность которого определяется концентрацией глюкозы крови,
-гормоны ЖКТ: холецистокинин, секретин, гастрин, энтероглюкагон, желудочный ингибирующий полипептид,
-хроническое воздействие гормона роста, глюкокортикоидов, эстрогенов, прогестинов.
Уменьшают: влияние симпато-адреналовой системы.
Механизм действия: После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки протеинфосфатазы. Конечным эффектом является дефосфорилирование «метаболических» ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
Мишени и эффекты: Основным эффектом является снижение глюкозы в крови благодаря усилению транспорта глюкозы внутрь миоцитов и адипоцитов и через активацию внутриклеточных реакций утилизации глюкозы.
Печень -активация ферментов гликолиза (гексокиназы, фосфофруктокиназы, пируваткиназы) и гликогеногенеза (гликогенсинтаза),
усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы) и ЛПОНП.
Мышцы -стимуляция транспорта глюкозы в клетки,
активация синтеза гликогена,
усиление транспорта нейтральных аминокислот в мышцы,
стимулирование трансляции, т.е. рибосомальный синтез белков.
стимулирование транспорта глюкозы в клетки,
активация синтеза липопротеинлипазы,
усиление синтеза жирных кислот через активацию ацетил-SКоА-карбоксилазы
усиление синтеза триацилглицеролов через инактивацию ТАГ-липазы.
Патология: Гипофункция — Инсулинзависимый и инсулиннезависимый сахарный диабет.
Согласно современным представлениям, биосинтез инсулина осуществляется в β-клетках панкреатических островков из своего предшественника проинсулина. Проинсулин представлен одной полипептидной цепью, содержащей 84 аминокислотных остатка; он лишен биологической, т.е. гормональной, активности. Местом синтеза проинсули-на считается фракция микросом β-клеток панкреатических островков; превращение неактивного проинсулина в активный инсулин (наиболее существенная часть синтеза) происходит при перемещении проинсулина от рибосом к секреторным гранулам путем частичного протеолиза (отщепление с С-конца полипептидной цепи пептида, содержащего 33 аминокислотных остатка и получившего наименование соединяющего пептида, или С-пепти-да). Длина и первичная структура С-пептида подвержена большим изменениям у разных видов животных, чем последовательность цепей А и В инсулина. Установлено, что исходным предшественником инсулина является препроинсулин, содержащий, помимо проинсулина, его так называемую лидерную, или сигнальную, последовательность на N-конце, состоящую из 23 остатков аминокислот; при образовании молекулы проинсулина этот сигнальный пептид отщепляется специальной пептидазой. Далее молекула проинсулина также подвергается частичному протеолизу, и под действием трипсиноподобной протеиназы отщепляются по две основные аминокислоты с N- и С-конца пептида С – соответственно дипептиды Aрг–Aрг и Лиз– –Aрг. Синтезированный из проинсулина инсулин может существовать в нескольких формах, различающихся по биологическим, иммунологическим и физико-химическим свойствам. Различают две формы инсулина: 1) свободную, вступающую во взаимодействие с антителами, полученными к кристаллическому инсулину, и стимулирующую усвоение глюкозы мышечной и жировой тканями; 2) связанную, не реагирующую с антителами и активную только в отношении жировой ткани. В настоящее время доказано существование связанной формы инсулина и установлена локализация ее в белковых фракциях сыворотки крови, в частности в области трансферринов и α-глобулинов. Молекулярная масса связанного инсулина от 60000 до 100000. Различают, кроме того, так называемую форму А инсулина, отличающуюся от двух предыдущих рядом физико-химических и биологических свойств, занимающую промежуточное положение и появляющуюся в ответ на быструю, срочную потребность организма в инсулине.
50. Сахарный диабет. Патогенез. Нарушения обмена веществ при сахарном диабете. Определение толерантности к глюкозе при диагностике сахарного диабета.
Сахарный диабет — заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина. Его классифицируют с учётом различия генетических факторов и клинического течения на две основные формы: диабет I типа — инсулинзависимый (ИЗСД), и диабет II типа — инсулиннезависимый (ИНСД).
1. Инсулинзависимый сахарный диабет — заболевание, вызываемое разрушением р-клеток островков Лангерханса поджелудочной железы. Деструкция β-клеток — результат аутоиммунных реакций. В аутоиммунной реакции принимают участие лимфоциты и макрофаги (моноциты). Эти клетки продуцируют цитокины, которые либо непосредственно повреждают β-клетки, либо опосредуют клеточные реакции против β-клеток. Провоцировать возникновение диабета I типа может вирусная инфекция, вызывающая деструкцию b-клеток. К таким вирусам, называемым β-цитотропными, относят вирусы оспы, краснухи, кори, цитомегаловирус, эпидемического паротита, Коксаки, аденовирус. Некоторые р-цитотропные вирусы вызывают лизис β-клеток. Известны некоторые токсические вещества, например, такие как производные нитрозомочевины и другие нитро- или аминосодержащие соединения, избирательно поражающие β-клетки и индуцирующие аутоиммунную реакцию. Кроме того, ИЗСД может быть результатом частичного генетически обусловленного дефекта системы иммунологического надзора и сочетаться с другими аутоиммунными заболеваниями. На долю ИЗСД приходится примерно 25-30% всех случаев сахарного диабета. Как правило, разрушение β-клеток происходит медленно, и начало заболевания не сопровождается нарушениями метаболизма. Когда погибает 80-95% клеток, возникает абсолютный дефицит инсулина, и развиваются тяжёлые метаболические нарушения. ИЗСД поражает в большинстве случаев детей, подростков и молодых людей, но может проявиться в любом возрасте (начиная с годовалого).
2. Инсулинонезависимый сахарный диабет — общее название нескольких заболеваний, развивающихся в результате относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени (например, дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала и др.). ИНСД поражает людей, как правило, старше 40 лет. Сахарный диабет II типа характеризуется высокой частотой семейных форм. Риск ИНСД у ближайших родственников больного достигает 50%, тогда как при ИЗСД он не превышает 10%. Заболевание поражает преимущественно жителей развитых стран, особенно горожан. Возможными причинами ИНСД могут быть: образование антител к рецепторам инсулина; генетический дефект пострецепторного аппарата инсулинзависимых тканей; нарушения регуляции секреции инсулина. К факторам, определяющим развитие и клиническое течение болезни, относят ожирение, неправильный режим питания, малоподвижный образ жизни, стресс. Мутации генов, контролирующих секрецию инсулина, энергетический обмен в β-клетках и обмен глюкозы в клетках-мишенях инсулина, приводят к возникновению нескольких форм ИНСД с аутосомно-доминантным наследованием. Основным провоцирующим фактором инсулинонезависимого диабета служит ожирение.
Этот тип диабета часто сочетается с гиперинсулинемией, что способствует ожирению. Таким образом, ожирение, с одной стороны, важнейший фактор риска, а с другой — одно из ранних проявлений сахарного диабета.
При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния.
1. Симптомы сахарного диабета. Для всех форм диабета характерно повышение концентрации глюкозы в крови — гипергликемия. После приёма пищи концентрация глюкозы может достигать 300-500 мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде, т.е. снижается толерантность к глюкозе. Снижение толерантности к глюкозе наблюдают в случаях скрытой (латентной) формы сахарного диабета. В этих случаях у людей отсутствуют жалобы и клинические симптомы, характерные для сахарного диабета, а концентрация глюкозы в крови натощак соответствует норме. Однако использование провокационных проб (например, сахарной нагрузки) выявляет снижение толерантности к глюкозе. Определение толерантности к глюкозе используют для диагностики сахарного диабета. Обследуемый принимает раствор глюкозы из расчёта 1 г на 1 кг массы тела (сахарная нагрузка). Концентрацию глюкозы в крови измеряют в течение 2-3 ч с интервалами в 30 мин. 1 — у здорового человека; 2 — у больного сахарным диабетом.

При дефиците инсулина уменьшается количество белков-переносчиков глюкозы (ГЛЮТ-4) на мембранах инсулинзависимых клеток (жировой ткани и мышц). В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия). В норме проксимальные канальцы почек реабсорбируют всю фильтрующуюся в клубочках глюкозу, если её уровень не превышает 8,9 ммоль/л (160 мг/дл).
К характерным признакам сахарного диабета относят также повышение концентрации в крови кетоновых тел — кетонемия. При низком соотношении инсулин/глюкагон жиры не депонируются, а ускоряется их катаболизм, так как гормончувствительная липаза в жировой ткани находится в фосфорилированной активной форме. Концентрация неэтерифицирован-ных жирных кислот в крови повышается. Печень захватывает жирные кислоты, окисляет их до ацетил-КоА, который, в свою очередь, превращается в β-гидроксимасляную и ацетоуксусную кислоты. В тканях ацетоацетат частично декарбоксилируется до ацетона, запах которого исходит от больных сахарным диабетом и ощущается даже на расстоянии. Увеличение концентрации кетоновых тел в крови (выше 20 мг/дл, иногда до 100 мг/дл) приводит к кетонурии. Накопление кетоновых тел снижает буферную ёмкость крови и вызывает ацидоз.
Ещё один характерный признак сахарного диабета — повышенный уровень в крови ли-попротеинов (в основном, ЛПОНП) — гипер-липопротеинемия. Пищевые жиры не депонируются в жировой ткани вследствие ослабления процессов запасания, а поступают в печень, где частично превращаются в триацилглицеролы, которые транспортируются из печени в составе ЛПОНП.
При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Это вызывает повышение концентрации аминокислот в крови. Аминокислоты поступают в печень и дезаминируются. Безазотистые остатки гликогенных аминокислот включаются в глюконеогенез, что ещё более усиливает гипергликемию. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и, соответственно, в моче — азотемия и азотурия.

2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы.
Нарушения обмена углеводов, жиров и белков при сахарном диабете могут приводить к развитию коматозных состояний (острые осложнения). Диабетическая кома проявляется в резком нарушении всех функций организма с потерей сознания. Основные предшественники диабетической комы — ацидоз и дегидратация тканей. Параллельно кетоацидозу при декомпенсации диабета развивается нарушение водно-электролитного обмена. В его основе лежит гипергликемия, сопровождающаяся повышением осмотического давления в сосудистом русле. Для сохранения осмолярности начинается компенсаторное перемещение жидкости из клеток и внеклеточного пространства в сосудистое русло. Это ведёт к потере тканями воды и электролитов, прежде всего ионов Na+, K+, С1-, НСО3. В результате развиваются тяжёлая клеточная дегидратация и дефицит внутриклеточных ионов (прежде всего К+), затем возникает общая дегидратация. Это приводит к снижению периферического кровообращения, уменьшению мозгового и почечного кровотока и гипоксии. Диабетическая кома развивается медленно, в течение нескольких дней, но иногда может возникнуть и в течение нескольких часов. Первыми признаками могут быть тошнота, рвота, заторможенность. АД у больных снижено.
Коматозные состояния при сахарном диабете могут проявляться в трёх основных формах: кетоацидотической, гиперосмолярной и лакто-ацидотической. Для кетоацидотической комы характерны выраженный дефицит инсулина, кетоацидоз, полиурия, полидипсия. Гипергликемия (20-30 ммоль/л), обусловленная инсулиновой недостаточностью, сопровождается большими потерями жидкости и электролитов, дегидратацией и гиперосмоляльностью плазмы. Общая концентрация кетоновых тел достигает 100 мг/дл и выше.
При гиперосмолярной коме наблюдают чрезвычайно высокие уровни глюкозы в плазме крови, полиурию, полидипсию, всегда проявляется тяжёлая дегидратация. Предполагают, что у большинства больных гипергликемия обусловлена сопутствующим нарушением функции почек. Кетоновые тела в сыворотке крови обычно не определяются.
При лактоацидотической коме преобладают гипотония, снижение периферического кровообращения, гипоксия тканей, приводящая к смещению метаболизма в сторону анаэробного гликолиза, что обусловливает повышение концентрации молочной кислоты в крови (лакто-ацидоз).
Разные варианты диабетической комы в чистом виде практически не встречаются. Их возникновение может быть обусловлено разными факторами, например инфекционными заболеваниями, травмами, хирургическими вмешательствами, токсическими соединениями и др.
3. Поздние осложнения сахарного диабета. Главная причина поздних осложнений сахарного диабета — гипергликемия. Гипергликемия приводит к повреждению кровеносных сосудов и нарушению функций различных тканей и органов.
Одним из основных механизмов повреждения тканей при сахарном диабете является гликозилирование белков, приводящее к изменению их конформации и функций. Некоторые белки в норме содержат углеводные компоненты, причём образование таких гликопротеинов протекает ферментативно (например, образование гликопротеиновых гормонов аденогипофиза). Однако в организме человека может происходить и неферментативное взаимодействие глюкозы со свободными аминогруппами белков — неферментативное гликозилирование белков. В тканях здоровых людей эта реакция протекает медленно. При гипергликемии процесс гликозилирования ускоряется. Степень гликозилирования белков зависит от скорости их обновления. В медленно обменивающихся белках накапливается больше изменений. К одним из первых признаков сахарного диабета относят увеличение в 2-3 раза количества гликозилированного гемоглобина (норма НbА1С 5,8-7,2%). Другим примером медленно обменивающихся белков служат кристаллины — белки хрусталика. При гликозилировании кристаллины образуют многомолекулярные агрегаты, увеличивающие преломляющую способность хрусталика. Прозрачность хрусталика уменьшается, возникает его помутнение, или катаракта.
К медленно обменивающимся белкам относятся белки межклеточного матрикса, базальных мембран. Утолщение базальных мембран, одно из характерных осложнений сахарного диабета, приводит к развитию диабетических ангиопатий.
Причиной многих поздних осложнений сахарного диабета также служит повышение скорости превращения глюкозы в сорбитол.
*Реакция превращения глюкозы в шестиатомный спирт (сорбитол) катализируется ферментом альдозоредуктазой. Сорбитол не используется в других метаболических путях, а скорость его диффузии из клеток невелика. У больных сахарным диабетом сорбитол накапливается в сетчатке и хрусталике глаза, клетках клубочков почек, шванновских клетках, в эндотелии.
*Сорбитол в высоких концентрациях токсичен для клеток. Его накопление в нейронах приводит к увеличению осмотического давления, набуханию клеток и отёку тканей. Так, например, помутнение хрусталика может развиться вследствие вызванного накоплением сорбитола набухания хрусталика и нарушения упорядоченной структуры кристаллинов.
Диабетические ангиопатии. Диабетические ангиопатий обусловлены прежде всего поражением базальных мембран сосудов. При высокой концентрации глюкозы в плазме крови протеогликаны, коллагены, гликопротеины гликозилируются, нарушается обмен и соотношение между компонентами базальных мембран, нарушается их структурная организация.
Макроангиопатии проявляются в поражениях крупных и средних сосудов сердца, мозга, нижних конечностей. Патологические изменения во внутренней оболочке артерий и повреждения артериальной стенки в средних и наружных слоях — следствие гликозилирования базальных мембран и белков межклеточного матрикса (коллагена и эластина), что приводит к снижению эластичности артерий. В сочетании с гиперли-пидемией это может быть причиной развития атеросклероза. При сахарном диабете атеросклероз встречается чаще, развивается в более раннем возрасте и прогрессирует значительно быстрее, чем в отсутствие диабета. Микроангиопатии — результат повреждения капилляров и мелких сосудов. Проявляются в форме нефро-, нейро- и ретинопатии.
Нефропатия развивается примерно у трети больных сахарным диабетом. Электронно-микроскопические изменения базальной мембраны в почечных клубочках можно обнаружить уже на первом году после установления диагноза. Однако у большинства больных клинические признаки диабетической нефропатии проявляются через 10-15 лет существования диабета. Признаком ранних стадий нефропатии служит микроальбуминурия (в пределах 30-300 мг/сут), которая в дальнейшем развивается до классического нефротического синдрома, характеризующегося высокой протеинурией, гипоальбуминемией и отёками.
Ретинопатия, самое серьёзное осложнение сахарного диабета и наиболее частая причина слепоты, развивается у 60-80% больных сахарным диабетом. На ранних стадиях развивается базальная ретинопатия, которая проявляется в кровоизлияниях в сетчатку, расширении сосудов сетчатки, отёках, Если изменения не затрагивают жёлтого пятна, потеря зрения обычно не происходит. В дальнейшем может развиться пролиферативная ретинопатия, проявляющаяся в новообразовании сосудов сетчатки и стекловидного тела. Ломкость и высокая проницаемость новообразованных сосудов определяют частые кровоизлияния в сетчатку или стекловидное тело. На месте тромбов развивается фиброз, приводящий к отслойке сетчатки и потере зрения.
Обычно диагноз сахарного диабета можно поставить на основе классических симптомов сахарного диабета — гипергликемии, полиурии, полидипсии, полифагии, ощущения сухости во рту. Важнейшие биохимические признаки ИЗСД выявляют на основе:
1. теста толерантности к глюкозе (см. рис. 11-30). Уровень глюкозы в плазме крови выше 10 ммоль/л через 2 ч после сахарной нагрузки свидетельствует о сахарном диабете;
2. определения гликозилированного гемоглобина. При сахарном диабете уровень НbА1с, в норме составляющий около 5% от всего содержания гемоглобина, увеличивается в 2-3 раза;
3. отсутствия или низкого уровня инсулина и С-пептида в крови и моче. В норме инсулин и С-пептид секретируются в эквимолярных концентрациях. Поскольку печенью задерживается примерно 2/3 инсулина, соотношение инсулин/С-пептид в воротной вене и периферических сосудах в норме составляет 1/3. Величина уровня С-пептида в сыворотке или моче позволяет достаточно точно оценить функциональное состояние β-клеток;
4. альбуминурии. При сахарном диабете суточное выведение альбумина составляет примерно 30-300 мг — микроальбуминурия (в норме около 8 мг).
Поскольку ИНСД развивается значительно медленнее, классические клинические симптомы, гипергликемию и дефицит инсулина диагностируют позднее, часто в сочетании с симптомами поздних осложнений сахарного диабета.
Лечение сахарного диабета зависит от его типа (I или II), является комплексным и включает диету, применение сахаропонижающих средств, инсулинотерапию, а также профилактику и лечение осложнений.
Современные сахаропонижающие препараты делят на две основные группы: производные суль-фонилмочевины и бигуаниды. К препаратам, действие которых направлено на стимуляцию секреции инсулина, относят производные сульфонилмочевины (например, манинил). Механизм действия препаратов сульфонилмочевины объясняют их влиянием на функцию АТФ-чувствительных К+-каналов. Повышение внутриклеточной концентрации К+ приводит к деполяризации мембраны и ускорению транспорта ионов кальция в клетку, вследствие чего стимулируется секреция инсулина.
Другую основную группу сахаропонижающих препаратов составляют бигуаниды. По данным некоторых исследований, бигуаниды увеличивают количество переносчиков глюкозы ГЛЮТ-4 на поверхности мембран клеток жировой ткани и мышц.
К перспективным методам лечения сахарного диабета относят следующие: трансплантация островков поджелудочной железы или изолированных β-клеток, трансплантация генетически реконструированных клеток, а также стимуляция регенерации панкреатических островков.
При сахарном диабете обоих типов важнейшее значение имеет диетотерапия. Рекомендуют хорошо сбалансированную диету: на долю углеводов должно приходиться 50-60% общей калорийности пищи (исключение должны составлять легкоусвояемые углеводы, пиво, спиртные напитки, сиропы, пирожные и др.); на долю белков — 15-20%; на долю всех жиров — не более 25-30%. Пищу следует принимать 5-6 раз в течение суток.
51. Соматотропный гормон, глюкагон и другие пептидные гормоны. Биологическое значение.
Строение: Представляет собой полипептид, включающий 191 аминокислоту с молекулярной массой 22 кДа и периодом полураспада 20-25 мин.
Синтез: Осуществляется в ацидофильных клетках гипофиза – подкласс соматотрофов с волнообразной секрецией и пиком каждые 20-30 мин.
Регуляция синтеза и секреции: Активируют: стресс (боль, тревога, холод), гипогликемия (при физической нагрузке и кратком голодании), андрогены и эстрогены, некоторые аминокислоты (например, аргинин), медленная фаза сна (вскоре после засыпания), морфин, вазопрессин, трийодтиронин (особенно у детей, через высвобождение соматолиберина).
Уменьшают: гипергликемия, соматомедины.
Механизм действия: Рецептор с каталитической тирозинкиназной активностью. Часть эффектов связана с увеличением количества молекул аденилатциклазы в цитоплазматической мембране. Существенную роль в эффектах гормона играют соматомедины (ростовые факторы), вырабатываемые в печени после воздействия на нее СТГ.
Мишени и эффекты: Мишенью являются костная, хрящевая, мышечная, жировая ткани и печень. Гормон стимулирует общий рост клетки-мишени, но не ее дифференцировку.
Белковый обмен: Вызывает положительный азотистый баланс, в целом повышает транспорт аминокислот в печень, мышечную, хрящевую и костную ткани, активирует все стадии биосинтеза белка.
Нуклеиновый обмен: Активирует синтез РНК и ДНК.
Углеводный обмен: Подавляет поглощение глюкозы в периферических тканях, переключая их на использование жирных кислот, стимулирует глюконеогенез и гликогенолиз в печени, что вызывает гипергликемию. В мышцах подавляет гликолиз и стимулирует синтез гликогена. У детей стимулирует образование хондроитинсульфата в костной ткани.
Жировой обмен: Активирует липолиз, накопление жирных кислот в крови и, при недостатке инсулина, кетогенез.
Минеральный обмен: Стимулирует гидроксилирование и активацию витамина D в почках. Формирует положительный баланс ионов Mg2+, Ca2+, Na+, К+, Cl–, SO42–, фосфатов.
Патология: Гипофункция — при уменьшении выработки и снижении концентрации в крови возникает гипофизарный нанизм (карликовость), частота в России около 1:20000. Проявляется на 2-4 году жизни, критерием служит снижение скорости роста до 4 см в год и менее. —при нарушении синтеза у взрослых отмечается снижение мышечной массы и тенденция к гипогликемии, —при нарушении рецепции или пострецепторной передачи сигнала происходит пропорциональное, но недостаточное развитие тела. Примером могут служить пигмеи, племена Центральной Африки.
Гиперфункция — у детей возникает гигантизм, так как еще нет зарастания эпифизарных щелей и возможен ускоренный рост кости; у взрослых развивается акромегалия – из-за акрального роста кости происходит увеличение размера носа, стопы, кистей, челюсти.
Пептиды проопиомеланокортина.Проопиомеланокортин представляет собой пептид, включающий 254 аминокислоты. При его гидролизе в клетках переднего и промежуточного гипофиза появляются три основные группы пептидов этого семейства:
1. Адренокортикотропный гормон ( АКТГ) из которого может образоваться α-меланоцитстимулирующий гормон (МСГ),
2. β-Липотропин, служащий предшественником α-липотропина, β-МСГ и β-эндорфина.
3. γ-Меланоцитстимулирующий гормон.
Указанные пептиды способны претерпевать дополнительные модификации с образованием новых регуляторных пептидов. Механизмы действия и эффекты большинства производных проопиомеланокортина недостаточно изучены.
Липотропный гормон. β-Липотропин представляет собой полипептид из 91 аминокислоты.
Мишени и эффекты: Мишенью являются жировая ткань, где он стимулирует липолиз и мобилизацию жирных кислот. Основная роль – источник эндогенных опиатов (α-, β-, γ-эндорфинов) в головном мозге, которые вызывают обезболивание, снятие ощущений страха и т.п.
Меланоцитстимулирующий гормон. Строение:Представляет собой группу пептидов α-, β-, γ-МСГ. По строению, например, α-МСГ включает 13 аминокислот, γ-МСГ включает 11 аминокислот.
Синтез:Происходит в средней доле гипофиза.
Механизм действия: Аденилатциклазный.
Мишени и эффекты: Мишенью являются меланоциты кожи, радужки, пигментного эпителия сетчатки глаза, в которых стимулирует меланиногенез и пигментацию.
Патология: Гиперфункция — Проявляется как симптом усиленной пигментации кожи при первичной недостаточности коры надпочечников (болезни Аддисона), в связи с чем такой гипокортицизм также называют «бронзовая болезнь».
Глюкагон.Строение:Представляет собой полипептид, включающий 29 аминокислот с молекулярной массой 3,5 кДа и периодом полураспада 3-6 мин.
Синтез: Осуществляется в клетках поджелудочной железы и в клетках тонкого кишечника.
Регуляция синтеза и секреции:Уменьшают: глюкоза.
Мишени и эффекты: Конечным эффектом является повышение концентрации глюкозы и жирных кислот в крови. Жировая ткань — повышает активность внутриклеточной гормон-чувствительной ТАГ-липазы и, соответственно, стимулирует липолиз.
Печень — активация глюконеогенеза и гликогенолиза, за счет повышенного поступления жирных кислот из жировой ткани усиливает кетогенез.
52. Гормоны коры надпочечников. Синтез, метаболизм, регуляция секреции. Глюкокортикостероиды, влияние на обмен веществ. Гипо- и гиперкортицизм.

Другие эффекты: Повышает чувствительность бронхов и сосудов к катехоламинам, что обеспечивает нормальное функционирование сердечно-сосудистой и бронхолегочной систем.
Патология:Гипофункция — Первичная недостаточность – болезнь Аддисона проявляется:
гипогликемия, повышенная чувствительность к инсулину, анорексия и снижение веса, слабость, гипотензия, гипонатриемия и гиперкалиемия, усиление пигментации кожи и слизистых (компенсаторное увеличение количества АКТГ, обладающего небольшим меланотропным действием).
Вторичная недостаточность возникает при дефиците АКТГ или снижении его эффекта на надпочечники – возникают все симптомы гипокортицизма, кроме пигментации.
Гиперфункция — Первичная – болезнь Кушинга проявляется:снижение толерантности к глюкозе – аномальная гипергликемия после сахарной нагрузки или после еды,гипергликемия из-за активации глюконеогенеза,ожирение лица и туловища (связано с повышенным влиянием инсулина при гипергликемии на жировую ткань) – буйволиный горбик, фартучный (лягушачий) живот, лунообразное лицо,глюкозурия,повышение катаболизма белков и повышение азота крови,остеопороз и усиление потерь кальция и фосфатов из костной ткани,снижение роста и деления клеток – лейкопения, иммунодефициты, истончение кожи, язвенная болезнь желудка и двенадцатиперстной кишки,нарушение синтеза коллагена и гликозаминогликанов,гипертония благодаря активации ренин-ангиотензиновой системы.Вторичная – синдром Иценко-Кушинга (избыток АКТГ) проявляется схоже с первичной формой. 
Активация ренин-ангиотензиновой системы. 1.Для активации этой системы существует два пусковых момента:
-снижение давления в приносящих артериолах почек, которое определяется барорецепторами клеток юкстагломерулярного аппарата. Причиной этого может быть любое нарушение почечного кровотока – атеросклероз почечных артерий, повышенная вязкость крови, обезвоживание, кровопотери и т.п.
-снижение концентрации ионов Na+ в первичной моче в дистальных канальцах почек, которое определяется осморецепторами клеток юкстагломерулярного аппарата. Возникает в результате бессолевой диеты, при длительном использовании диуретиков.
2. При выполнении одного или обоих пунктов клетки юкстагломерулярного аппарата активируются и из них в плазму крови секретируется фермент ренин.
3. Для ренина в плазме имеется субстрат – белок глобулиновой фракции ангиотензиноген.
4. В результате протеолиза от белка отщепляется декапептид под названием ангиотензин I.
5. Ангиотензин I при участии ангиотензин-превращающего фермента превращается в ангиотензин II.
6. Главными мишенями ангиотензина II служат кровеносные сосуды и клубочковая зона коры надпочечников.
7. Стимуляция кровеносных сосудов вызывает их спазм и восстановление артериального давления.
8. Из надпочечников после стимуляции секретируется альдостерон, действующий на дистальные канальцы почек.
9. При воздействии на канальцы почек увеличивается реабсорбция ионов Na+, вслед за натрием движется вода. В результате давление в системе вос-ся и концентрация ионов натрия увеличивается в плазме крови, а, значит и в первичной моче.
Транспорт кортикостеровдов. Кортизол в плазме крови находится в комплексе с α-глобулином транскортином и в небольшом количестве в свободной форме. Синтез транскортина протекает в печени и стимулируется эстрогенами. Т1/2 кортизола составляет 1,5-2 ч. Несвязанный, или свободный кортизол, составляет около 8% от общего количества гормона в плазме и является биологически активной фракцией. Альдостерон не имеет специфического транспортного белка, но образует слабые связи с альбумином. Катаболизм гормонов коры надпочечников происходит прежде всего в печени. Здесь протекают реакции гидроксилирования, окисления и восстановления гормонов. Продукты катаболизма кортикостеровдов (кроме кортикостерона и альдостерона) выводятся с мочой в форме 17-кетостероидов, образующихся в результате отщепления боковой цепи. Эти продукты метаболизма выделяются преимущественно в виде конъюгатов с глюкуроновой и серной кислотами. Определение 17-кетостероидов в моче позволяет оценить как количество глюкокортикоидов, секретируемых корой надпочечников, так и функцию надпочечников. Мишени и эффекты:Воздействует на слюнные железы, на дистальные канальцы и собирательные трубочки почек. В почках усиливает реабсорбцию ионов натрия и потерю ионов калия посредством следующих эффектов: увеличивает количество Na+,K+-АТФазы на базальной мембране эпителиальных клеток, стимулирует синтез митохондриальных белков и увеличение количества нарабатываемой в клетке энергии для работы Na+,K+-АТФазы, стимулирует образование Na-каналов на апикальной мембране клеток почечного эпителия.
Патология:Гипофункция—Не отмечена.Гиперфункция — Синдром Конна (первичный альдостеронизм) – возникает при аденомах клубочковой зоны. Характеризуется триадой признаков: гипертензия, гипернатриемия, алкалоз.Вторичный гиперальдостеронизм – гиперплазия и гиперфункция юкстагломерулярных клеток и избыточная секреция ренина и ангиотензина II.
53. Строение, синтез и метаболизм йодтиронинов. Влияние на обмен веществ. Гипо- и гипертиреозы: механизм возникновения и последствия.

Йодтиронины синтезируются в составе белка тиреоглобулина (Тг) в фолликулах, которые представляют собой морфологическую и функциональную единицу щитовидной железы. Тиреоглобулин синтезируется в базальной части клеток, перемещается к просвету и хранится во внеклеточных коллоидах, при тиреотропной стимуляции пиноцитируется фолликулярными клетками, сливается с лизосомами и гидролизуется. Три- и тетрайодтиронин секретируются в кровь. В крови гормоны транспортируются специфическим глобулином, а также альбумином. Этапы синтеза тиреоидных гормонов: 1.Транспорт йода в клетки щитовидной железы: Йод в виде органических и неорганических соединений поступает в ЖКТ с пищей и питьевой водой. Суточная потребность в йоде составляет 150-200 мкг. 25-30% этого количества йодидов захватывается щитовидной железой. Транспорт йодида в кл щитовидной железы — энергозависимый процесс и происходит при участии транспортного белка против электрохимического градиента (соотношение концентраций I- в железе к концентрации I- в сыворотке крови в норме составляет 25:1). Работа этого йодид-переносящего белка сопряжена с Nа+,К+-АТФ-азой. Концентрационная способность железы регулируется ТТГ 2. Окисление йода. Окисление I — в I + происходит при участии гемсодержащей тиреопероксидазы и Н2О2 в качестве окислителя. Окисление йодида до состояния с более высокой валентностью, что необходимо для органификации йодида и биосинтеза тиреоидных гормонов. 3. Йодирование тирозина (органификация йодида) – Окисленный йод взаимодействует с остатками тирозина в молекуле тиреоглобулина. Эта реакция также катализируется тиреопероксидазой. 4. Образование йодтиронинов. Под действием тиреопероксидазы окисленный йод реагирует с остатками тирозина с образованием монойод-тирозинов (МИТ) и дийодтирозинов (ДИТ). Две молекулы ДИТ конденсируются с образованием йодтиронина Т4, а МИТ и ДИТ — с образованием йодтиронина Т3. Йодтиреоглобулин транспортируется из коллоида в фолликулярную клетку путём эндоцитоза и гидролизуется ферментами лизосом с освобождением Т3 и Т4. Если йода поступает достаточно, соотношение Т4/Т3=7:1. При недостатке, Т4/Т3 и ДИТ/МИТ снижается. Чем хуже железа обеспечена йодом, тем выше доля МИТ и Т3, что считается компенсаторным явлением.
Регуляция синтеза и секреции:Активируют: тиреотропный гормон на этапах поглощения йода, синтеза тиреоглобулина, эндоцитоза и секреции Т3 и Т4 в кровь.Уменьшают: тироксин и трийодтиронин (по механизму обратной отрицательной связи), высокие концентрации йода в крови (бесконтрольный прием препаратов KJ).
Метаболизм йодтиронинов.От половины до двух третей Т3 и Т4 находятся в организме вне щитовидной железы. Большая часть их циркулирует в крови в связанной форме в комплексе с белками: тироксинсвязывающим глобулином (ТСГ) и тироксинсвязывающим преальбумином (ТСПА). ТСГ служит основным транспортным белком йодтиронинов, а также формой их депонирования. Он обладает более высоким сродством к Т3 и Т4 и в нормальных условиях связывает почти всё количество этих гормонов. Только 0,03% Т4 и 0,3% Т3 находятся в крови в свободной форме. Т1/2 Т4 в плазме в 4-5 раз больше, чем Т3. Для Т4 этот период составляет около 7 дней, а для Т3 — 1-1,5 дня. Биологическая активность йодтиронинов обусловлена несвязанной фракцией. Т3 — основная биологически активная форма йодтиронинов; его сродство к рецептору клеток-мишеней в 10 раз выше, чем у Т4. Другие пути метаболизма йодтиронинов включают полное дейодирование, дезаминирование или декарбоксилирование. Йодированные продукты катаболизма йодтиронинов конъюгируют-ся в печени с глюкуроновой или серной кислотами, секретируются с жёлчью, в кишечнике вновь всасываются, дейодируются в почках и выделяются с мочой. Механизм действия: Цитозольный.
Мишени и эффекты: Клетки-мишени йодтиронинов имеют 2 типа рецепторов к этим гормонам. Основные эффекты йодтиронинов — результат их взаимодействия с высокоспецифичными рецепторами, которые в комплексе с гормонами постоянно находятся в ядре и взаимодействуют с определёнными последовательностями ДНК, участвуя в регуляции экспрессии генов. Другие рецепторы расположены в плазматической мембране клеток, но это не те же самые белки, что в ядре. Они обладают более низким сродством к йодтиронинам и обеспечивают связывание гормонов для удержания их в непосредственной близости к клетке. Рецепторы к йодтиронинам имеют все ткани организма. В клетках-мишенях тироксин дейодируется и активной формой является трийодтиронин (3,5,3′-производное). Эта реакция ослаблена у плода, новорожденных и престарелых. Главным эффектом трийодтиронина является повышение активности Na+,K+-АТФазы, что приводит к быстрому расходованию АТФ и по механизму дыхательного контроля запускает катаболизм углеводов и липидов. В митохондриях увеличивается количество АТФ/АДФ-транслоказы и потребление кислорода. Сопутствующим эффектом усиления катаболизма является наработка тепла.
Белковый обмен: Усиливает транспорт аминокислот в клетки. Активирует синтез дифференцировочных белков в ЦНС, гонадах, костной ткани и обусловливает развитие этих тканей.
Углеводный обмен: Увеличивает гликогенолиз и аэробное окисление глюкозы.
Липидный обмен: Стимулирует липолиз, β-окисление жирных кислот, подавляет стероидогенез.
Нуклеиновый обмен: Активирует начальные стадии синтеза пуринов и синтеза пиримидинов, стимулирует дифференцировочный синтез РНК и ДНК.
Также трийодтиронин усиливает выделение соматолиберина, что стимулирует секрецию гормона роста, также опосредует его метаболические эффекты. Этот эффект обеспечивает у детей в целом анаболическое действие тиреоидных гормонов. У взрослых действие тиреоидных гормонов в целом катаболическое, в надпочечниках подавляет синтез катехоламинов.
Патология.Гипофункция. Причина. Развивается при снижении синтеза гормонов в результате недостаточной стимуляции со стороны гипофиза и гипоталамуса, при заболевании самой железы, при нехватке необходимых веществ (аминокислоты, йод, селен). В 90% случаев причиной выраженного гипотиреоза является болезнь Хашимото, при которой вырабатываются блокирующие антиантитела к рецепторам ТТГ.Клиническая картина. Симптомами субклинического гипотиреоза, зачастую неспецифическими, могут быть отечность, сухость кожи и волос, брадикардия, легкое увеличение массы тела, повышение диастолического давления (точнее – понижение систолического), вялость, сонливость, запоры, чувствительность к холоду, снижение утренней температуры тела до 36,0°-35,5°С и ниже, бледность, скованность мышц, психическая инертность, апатия. У подростков отмечается отставание в физическом развитии, позднее половое созревание, функциональная дебильность, т.е. замедление мышления, снижение успеваемости в школе, неспособность к творческой деятельности, утрата чувства юмора.При наличии выраженного гипотиреоза у плодов, новорожденных и детей младшего возраста развивается кретинизм. При возникновении выраженного гипотиреоза у взрослых отмечается микседема, у женщин – бесплодие и галакторея, у обоих полов – деменция, психоз.
Гиперфункция. Причина. 90% случаев выраженного гипертиреоза вызвано наличием активирующих антиантител к рецепторам ТТГ. В этом случае заболевание носит название болезнь фон Базедова (в отечественной и европейской литературе), болезнь Грейвса (в американской литературе).
Клиническая картина. Симптомами гипертиреоза являются субфебрильная температура (до 37,5°С, особенно к вечеру), нервное возбуждение, эмоциональная лабильность и нервозность (плаксивость), похудание, мышечная слабость, повышение аппетита, тахикардия, потливость, непереносимость жары, тремор, диарея.
54. Катехоламины. Синтез, депонирование и метаболизм катехоламинов. Механизм действия. Влияние на обмен веществ.
Подобно задней доле гипофиза, мозговой слой надпочечников — производное нервной ткани. Его можно рассматривать как продолжение симпатической нервной системы, так как преганглионарные волокна чревного нерва оканчиваются на хромаффинных клетках мозгового слоя надпочечников. При стимуляции преганглионарного нейрона хромаффинные клетки продуцируют катехоламины (они относятся к группе фенилалкиламинов) — адреналин (80%), норадреналин (20%), дофамин (менее1%). По химическому строению катехоламины — 3,4-дигидроксипроизводные фенилэтиламина. Непосредственным предшественником гормонов служит тирозин. Собственно гормоном можно назвать только адреналин, поскольку два других катехоламина играют в основном медиаторную роль: норадреналин – в симпатической нервной системе, дофамин – в центральной. Адреналин относят к медиаторам симпатической и центральной нервной системы, а также к стресс-гормонам.

В плазме крови катехоламины образуют непрочный комплекс с альбумином. Адреналин транспортируется в основном к печени и скелетным мышцам. Норадреналин образуется в основном в органах, иннервируемых симпатическими нервами (80% от общего количества). Норадреналин лишь в незначительных количествах достигает периферических тканей. Основная часть катехоламинов быстро метаболизируется в различных тканях при участии специфических. Лишь небольшая часть адреналина (
5%) выделяется с мочой. Регуляция синтеза и секреции: Активируют: стимуляция чревного нерва, стресс. Уменьшают: гормоны щитовидной железы. Катехоламины действуют на клетки-мишени через рецепторы, локализованные в плазматической мембране. Механизм действиягормонов разный в зависимости от рецептора (R). Конечный эффект гормонов зависит от преобладания типа рецепторов на клетке и концентрации гормона в крови. Выделяют 2 главных класса таких рецепторов: α-адренергические и β-адренергические. Все рецепторы катехоламинов — гликопротеины, передают сигналы в клетки с помощью разных вторичных посредников. Это определяет характер их влияния на метаболизм клеток-мишеней. Адреналин взаимодействует как с α-R, так и с β-R; норадреналин в физиологических концентрациях главным образом взаимодействует с α-R. Аденилатциклазный механизм: а) при задействовании α2-адренорецепторов аденилатциклаза ингиб-ся,
б) при задействовании β1- и β2-адренорецепторов аденилатциклаза активируется. Кальций-фосфолипидный механизм: при возбуждении α1-адренорецепторов.Мишени и эффекты: 1)При возбуждении α1-адренорецепторов (печень, СС и мочеполовая системы): активация гликогенолиза, сокращение гладких мышц кровеносных сосудов и мочеполовой системы.2) При возбуждении α2-адренорецепторов (жировая ткань, поджелудка, почки):подавление липолиза (уменьшение стимуляции ТАГ-липазы), подавление секреции инсулина и секреции ренина. 3) При возбуждении β1-адренорецепторов (есть во всех тк): активация липолиза, увеличение силы и ЧСС миокарда. 4)При возбуждении β2-адренорецепторов (есть во всех тк): стимуляция гликогенолиза в печени и мышцах, и глюконеогенеза в печени, расслабление гладких мышц бронхов, кровеносных сосудов, мочеполовой системы и ЖКТ. В целом катехоламины отвечают за биохимические реакции адаптации к острым стрессам, связанным с мышечной активностью – «борьба или бегство»: -усиление липолиза и продукция жирных кислот в жировой ткани для мышечной активности, -гипергликемия за счет глюконеогенеза и гликогенолиза в печени для повышения устойчивости ЦНС, -стимуляция гликогенолиза в мышцах, -активация протеолиза в лимфоидной ткани для обеспечения глюконеогенеза субстратом (АК), -снижение анаболических процессов через уменьшение секреции инсулина.
Адаптация также прослеживается в физиологических реакциях: -мозг – усиление кровотока и стимуляция обмена глюкозы,
-мышцы – усиление сократимости, -ССС – увеличение силы и ЧСС миокарда, -легкие – расширение бронхов, улучшение вентиляции и потребления О2, -кожа – снижение кровотока. Удаление катехоламинов из синаптич. щели происходит путем обратного захвата в пресинаптич. окончания. Этот активный транспорт происходит с использованием энергии градиента Na + на мембране. Часть катехоламинов диффундирует из синапса в межклеточное пространство и затем поступает в кровь. Инактивируются катехоламины путем окислит, дезаминирования, катализируемого катехол-О-метилтрансферазой. Метаболиты катехоламинов удаляются из организма почками, поэтому их содержание в моче может указывать на активность симпатич. НС и мозгового слоя надпочечников.
Основная патология мозгового вещества надпочечников — феохромоцитома, опухоль, образованная хромаффинными клетками и продуцирующая катехоламины. Клинически феохромоцитома проявляется повторяющимися приступами головной боли, сердцебиения, потливости, повышением АД и сопровождается характерными изменениями метаболизма.
Не нашли то, что искали? Воспользуйтесь поиском:
Источник статьи: http://campodinamico.ru/cherez-geneticheskiy-apparat-gormon/
Генные и клеточные лекарства: сложное регулирование для сложных продуктов
Генные и клеточные лекарства: сложное регулирование для сложных продуктов
Как и в случае прочих лекарств, разработка генной и клеточной терапий строго регулируется. В связи с новизной и сложностью объектов в этой области много интересных особенностей.
Автор
Редакторы
Во второй статье нашего спецпроекта мы расскажем об особенностях регулирования генных и клеточных продуктов, о трудностях, с которыми сталкиваются разработчики в связи с невообразимой сложностью этих лекарств и о способах, которыми обеспечивается качество в процессе их разработки и производства.
Генная и клеточная терапии
Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
В первой статье спецпроекта о генной и клеточной терапиях («Генная терапия: познакомьтесь с лекарствами будущего» [1]) рассказывается о генной терапии: ее истории, первых успехах и самых современных разработках. В этой статье мы поговорим о том, как регулируется эта область разработки и производства лекарств с точки зрения научных стандартов и критериев, как различия между более традиционными лекарственными средствами и передовыми генными и клеточными терапиями приводят к разнице в подходах к обеспечению контроля качества при их производстве.
Попытки использования генетических и клеточных технологий в медицинских целях для лечения или профилактики заболеваний насчитывают не одно десятилетие и стали предприниматься параллельно с созданием технологии получения рекомбинантных белков. В частности, первые указания FDA (U.S. Food and Drug Administration), делающие попытку упорядочить подходы к разработке таких продуктов и сформулировать критерии для выведения их на рынок, были приняты еще в далеком 1991 г. Вместе с тем первый препарат для клеточной терапии был одобрен в США только в 2010-м (аутологичная клеточная иммунотерапия бессимптомного или минимально симптомного метастатического гормон-резистентного рака предстательной железы — сипулейцел-T), а первый генотерапевтический препарат вышел на рынок США и вовсе в 2015 г. с целью местной терапии нерезектабельных кожных, подкожных и узловатых очагов у пациентов с меланомой, рецидивирующей после радикальной хирургии.
Вот и получается, что, несмотря на достаточно длительную историю разработки этих технологий, конкретная медицинская практика и ее первые плоды появились совсем недавно, а потому генные и клеточные терапии — всё еще очень новое лечение. Такой «неторопливый» старт показывает, что пока наших знаний и умений недостаточно для уверенного создания терапевтических продуктов, лечащих за счет модификации генетического аппарата или восполнения утраченных клеток. Сегодня вклад в медицину этой группы лекарств весьма скромен. Число одобренных продуктов не превышает нескольких десятков, а сами они предназначены для лечения, как правило, редких заболеваний. Но темп разработок растет, и многие заболевания уже находятся «на очереди» у генных и клеточных технологий, а потому нет основания не верить, что в итоге прилагаемые усилия увенчаются успехом.
Недостаточно разработать и протестировать эффективные и безопасные лекарственные препараты генной и клеточной терапий. Разработчикам также нужно организовать их производство и обеспечить всесторонний контроль качества технологических процессов. При этом надо максимально стандартизировать все процедуры, чтобы все производимые серии препаратов были идентичны по своим характеристикам.
Выработкой требований к лекарственным препаратам и критериев их оценки занимается регуляторная наука. Это целый комплекс научных дисциплин, которые имеют отношение к оценке качества, безопасности и эффективности препаратов и создают основу для принятия регуляторных решений на протяжении всего жизненного цикла лекарства. Регуляторная наука охватывает фундаментальные и прикладные медицинские и социальные науки, а также вносит вклад в разработку регуляторных стандартов и инструментов.
В связи с тем, что регуляция лекарств наиболее развита на территориях ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международного совета по гармонизации технических требований к лекарствам для медицинского применения, поддерживающего систему руководств по научно обоснованной разработке лекарств), в первую очередь в США и ЕС, далее мы рассматриваем правила регулирования на основе того, как они изложены в руководствах ICH, а российских особенностей коснемся в последнем разделе.
Жизненный цикл лекарства совокупность всех фаз жизни препарата от начальной разработки до воплощения и окончательного вывода с рынка.
Принадлежность к биопрепаратам
Как «Биомолекула» уже писала раньше, историю новых лекарственных разработок удобно рассматривать как идущие друг за другом три поколения лекарств. Первое — низкомолекулярные лекарства, второе — биопрепараты, а третье — передовая терапия, в первую очередь генная и клеточная.
С регуляторной точки зрения генные и клеточные терапии — это лекарства, получаемые из биологических источников [2–4]. И те, и другие — макромолекулярные сущности с чрезвычайно сложными характеристиками, которые невозможно описать и установить полностью. Они производятся биологическими системами (включая организм человека в случае клеточных препаратов), что вносит большую вариабельность в результат процесса производства (об этой особенности биопрепаратов говорилось в материале «Биомолекулы» «Контроль качества биотехнологических продуктов» [5]). В этом ключе в отношении биопрепаратов еще на заре биотехнологической эры возникло понимание, метко описанное высказыванием, что процесс — есть продукт (process is the biologic) [6]. Другими словами, специалисты осознали, что характеристики получаемого биопрепарата (то есть его качество), определяющие профиль его безопасности и эффективности, неотделимы от условий и параметров его производства. Важное следствие: чтобы получить качественный продукт, необходимо строго контролировать параметры производства, потому что их вариабельность, скорее всего, приведет к отклонению в их эффективности и безопасности [7]. Этот факт имел и продолжает иметь конкретный практический аспект: если параметры процесса производства сильно влияют на качество получаемого продукта, то контроль параметров производства вносит существенный вклад в общий профиль качества, а вариабельность таких условий может приводить к получению продукта с другими характеристиками, а по сути, нового продукта.
Эти особенности биопрепаратов определяют [6], [8], [9]:
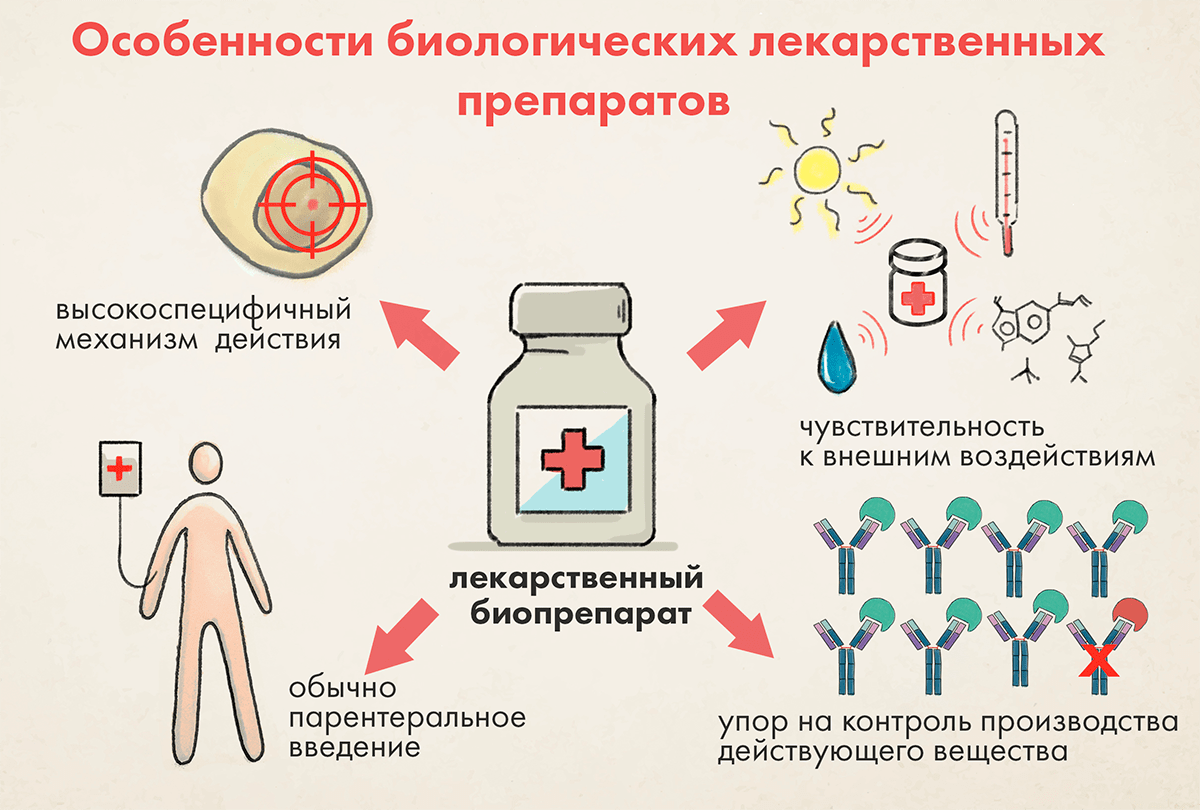
- высокую специфичность механизма действия и «прицельность», что обусловливает их низкую неспецифическую токсичность, а их небезопасность в первую очередь опосредуется фармакологическим действием (то есть воздействием на мишень[10]) и иммуногенностью, а также способностью к неконтролируемой репликации или пролиферации и росту;
- высокую чувствительность к окружающим факторам, в результате чего как производство, так и хранение, транспортировка, реализация и применение биопрепаратов должны осуществляться в щадящих, строго контролируемых условиях. Клетки-продуценты очень требовательны к условиям содержания;
- неустойчивость во внешней среде, из-за чего биопрепараты, как правило, должны находиться в водных средах или подвергаться лиофилизации, в то время как низкомолекулярные вещества не имеют таких сильных ограничений, и зачастую могут находиться в капсулах, таблетках и т. п.;
- преимущественно парентеральный путь введения (как правило, внутривенно); поскольку при этом препарат поступает во внутренние среды организма, минуя защитные барьеры, их необходимо тщательно стерилизовать, что создает дополнительные проблемы, так как биопрепараты подвержены биологической контаминации и не могут подвергаться агрессивным методам стерилизации и очистки для устранения бионагрузки;
- основной упор на разработку биологического действующего вещества, обеспечение однородности его свойств, очистку и поддержание стабильности; разработка формуляции (водного раствора) относительно проста по сравнению с усилиями, прилагаемыми к разработке лекарственной формы для низкомолекулярных действующих веществ (таблетки, мази, аэрозоли, пластыри).
В то время как для лекарств, содержащих низкомолекулярные действующие вещества, качество нередко можно обеспечить с помощью выборочных испытаний конечного продукта, для биопрепаратов это невозможно. Поэтому определение биопрепарата в Европейском [3] и в Евразийском экономическом [4] союзах выглядит так:
Биопрепарат лекарство, действующее вещество которого вырабатывается биологическим источником или выделяется из него, требующее в целях установления его характеристик и определения его качества комбинации физико-химических и биологических испытаний вместе с испытаниями процесса производства и его контроля.
- биотехнологические;
- иммунологические (вакцины, гетерологичные иммуноглобулины и иммуносыворотки, диагностикумы и аллергены);
- препараты, получаемые из плазмы (альбумин, факторы свертывания, иммуноглобулин человека);
- препараты передовой терапии, включающие препараты для генной и клеточной терапий, а также препараты тканевой инженерии;
- нерекомбинантные препараты (ботулотоксины, пищеварительные ферменты, урофоллитропины, гепарины и т. д).
Рисунок 1. Основные особенности биопрепаратов, отличающие их от низкомолекулярных лекарств
Всесторонний контроль качества не ограничивается тестированием качества биопрепарата по окончании всего процесса производства, а состоит из следующих аспектов (рис. 1):
- тщательный отбор и тестирование исходных и сырьевых материалов, прежде чем они будут введены в процесс производства;
- микробиологический контроль исходных и сырьевых материалов, соблюдение правил асептики во время производства и удаление и инактивация вирусов;
- сложная стратегия контроля многостадийного процесса производства — более сложного, чем синтез низкомолекулярных действующих веществ (табл. 1).
| Требования из расчета на серию АФИ* | Низкомолекулярное вещество | Биопрепарат |
|---|---|---|
| Записи о серии | 250 | |
| Испытания на качество препарата | 2000 | |
| Критичные стадии процесса | 5000 | |
| Число фиксируемых показателей/параметров процесса | 60 000 | |
| * АФИ — активный фармацевтический ингредиент, компонент лекарственного препарата, являющийся действующим веществом или становящийся им в организме человека. | ||
Из таблицы видно, насколько биопроцессы сложнее процессов химического синтеза низкомолекулярных веществ. Более того, чем более сложную организацию имеет производимое биологическое вещество, тем труднее будет создать, поддерживать и контролировать этот процесс. А генная и клеточная терапии — это на сегодняшний день и есть самые сложные в производстве биологические препараты.
Хотя у биологических лекарственных препаратов есть общие черты, отличающие их от низкомолекулярных веществ, они представляют собой достаточно неоднородную группу. Разные биопрепараты могут существенно различаться между собой как по характеристикам безопасности и эффективности, так и с точки зрения производства и контроля качества.
Рассматриваемые нами препараты передовой терапии хотя и объединены в общую категорию, также сильно отличаются друг от друга, пересекаясь только в случае терапевтических генетически модифицированных клеток (например, CAR-T [12]; свежий пример одобренного FDA препарата CAR-T — препарат для лечения мантийноклеточной лимфомы брексукаптагена аутолейцел, Tecartus), которым присущи особенности как генотерапевтических конструкций, так и клеточных препаратов. Тем не менее важно рассмотреть отличия передовых терапий от наиболее обширной и развитой группы биопрепаратов — рекомбинантных терапевтических белков. В таблице 2 приведены важные различия в производстве рекомбинантных белков и препаратов передовой терапии, которые приводят к соответствующим рискам для пациента, а также определяют стратегию контроля для их минимизации. Кроме того, особенности производства и контроля также влияют на затраты и тем самым на доступность лекарств для здравоохранения.
| Рекомбинантные белки | Генотерапевтики | Клеточные препараты | |
|---|---|---|---|
| Разработка препарата | Генная инженерия | Генная инженерия | Человеческий материал (иногда в сочетании с генной инженерией) |
| Физическая доступность исходных материалов | Высокая | Высокая | Низкая в случае аутологичных препаратов |
| Источник | Система банков клеток | Система или системы банков клеток (экспрессирующая конструкция, пакующие клетки) | Сами клетки человека (аутологичные препараты) или банк клеток (аллогенные) |
| Клональность | Да | Да | Может быть в случае аллогенных препаратов |
| Возможность установления физико-химических и биологических характеристик | Очень высокая | Умеренная | Сильно ограниченная |
| Очистка | Высокая | Средняя | Почти отсутствует |
| Удаление / инактивация вирусов | Да | Ограниченно | Нет |
| Микробиологические риски | Ничтожны | В случае вирусных векторов — из самого вектора. Есть риск того, что при производстве аденовирусного препарата останутся не инактивированные вирусные частицы | Высокие |
| Выпускающий контроль до введения пациенту | Полный | Полный | Неполный (например, мы не в состоянии, провести формальные микробиологические тесты для CAR-T) |
| Хранение | Длительное | Длительное | Хранение клеток в жидком азоте практически не ограничено по времени, но лимитируется регуляторикой, однако не все клетки хранятся таким образом, для некоторых хранение сверхкороткое или невозможно |
| Трудоемкость и сложность процесса в расчете на дозу | + | ++ | +++, особенно для аутологичных препаратов |
| Основной риск примесей | Иммуногенность | Иммуногенность, вирулентность | Туморогенность, эктопическое биораспределение |
Препараты на основе клеток
Терапевтические продукты на основе клеток достаточно разнообразны:
- живые донорские органы человека, предназначенные для трансплантации;
- живые донорские ткани и клетки человека, предназначенные для трансплантации без какой-либо модификации;
- живые форменные элементы крови человека для трансфузий, не подвергающиеся какой-либо модификации;
- живые клетки человека, включая форменные элементы крови, подвергающиеся различным манипуляциям для придания им определенных свойств или наращивания биомассы;
- живые органы, ткани и клетки животных для ксенотрансплантации.
В нашей статье мы не будем рассматривать ксеногенные материалы и трансплантацию органов и остановимся только на продуктах человеческого происхождения. В качестве лекарственных препаратов регулируются только те клетки человека, которые подвергаются существенным манипуляциям для наделения их полезными свойствами (например, генетической модификации, обработке факторами роста и т. д.) или наращивания биомассы [3], [13]. Регулирование в качестве лекарственных препаратов — самое строгое среди всех потребительских товаров и предполагает выполнение обширных требований, направленных на обеспечение не только их безопасности для пациентов, но и обладание ими заявляемых терапевтических свойств (эффективности) [14].
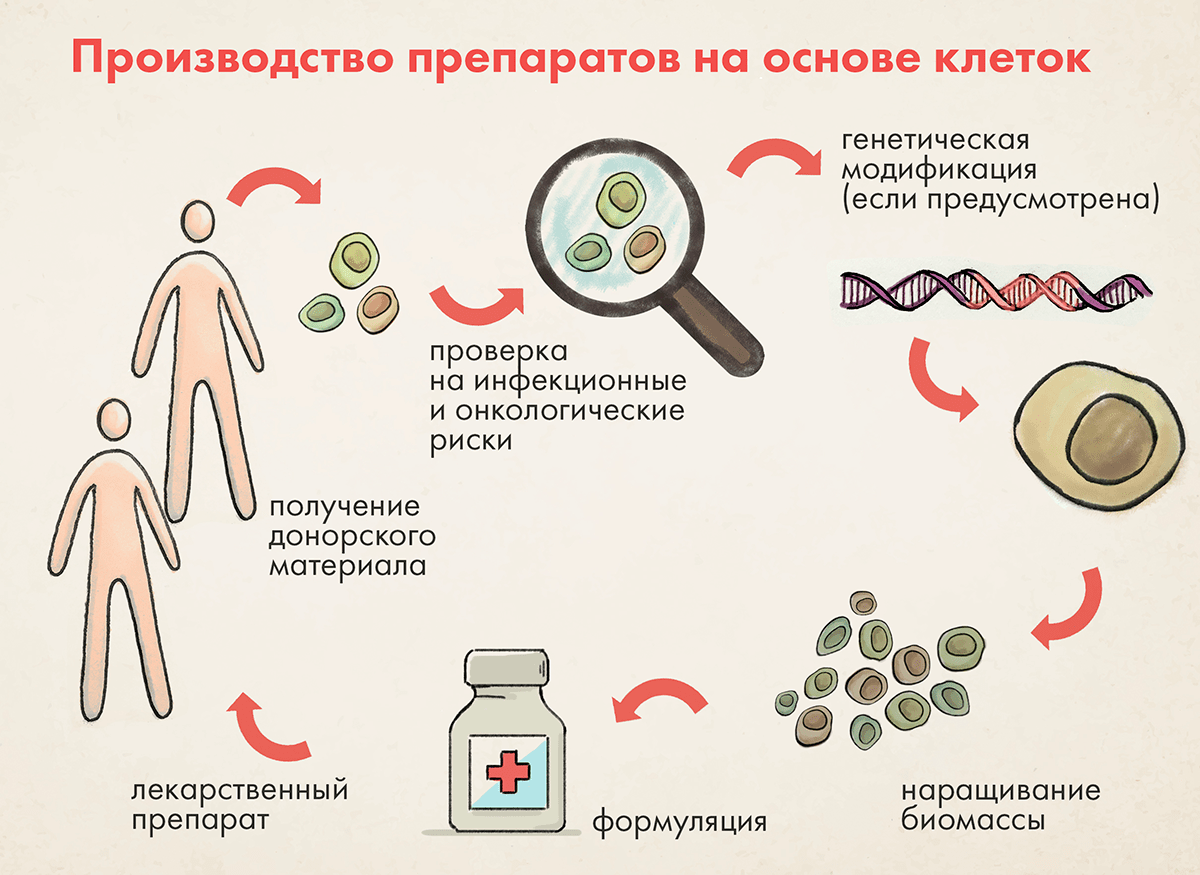
Отправная точка производства клеточных препаратов — клетки человека (рис. 2). Их получают от живых или посмертных доноров.
Рисунок 2. Схематическое представление стадий получения клеточных лекарственных препаратов. Источником клеток является человек. Взятые из источника клетки оцениваются на предмет рисков, подвергаются различным модификациям, дозируются и вводятся либо донору клеток, либо другим реципиентам.
Живые клетки человека могут быть опасны, поэтому в ходе фармацевтической разработки необходимо решать следующие проблемы или минимизировать связанные с ними риски [15–19]:
- Инфекционные и онкологические риски. Донор может быть инфицирован известными или неизвестными микроорганизмами (наибольший риск представляют вирусы и прионы), либо донорский материал может содержать клетки, подвергшиеся или стоящие на пороге опухолевой трансформации.
Эта категория рисков значима, если донорский материал будет использоваться для получения аллогенных препаратов, то есть их реципиентами будут другие люди, а не сам донор. Из-за высокой восприимчивости клеточных препаратов к любым методам деконтаминации (которые по определению агрессивны) для обеспечения микробиологической безопасности невозможна ни химическая, ни термическая, ни лучевая обработка. Кроме того, крупные размеры клеток не позволяют использовать противомикробные фильтры для фильтрации бактерий, микоплазмы и вирусов. В этом ключе главное средство инфекционной безопасности на этапе производства — строжайший отбор доноров. Его критерии могут быть смягчены только в случае аутологичного донорства (то есть донорства для собственных нужд) [20], [21]. Вместе с тем никакой строгий отбор не способен гарантировать полную инфекционную безопасность, поэтому остаточный риск неустраним и требует понимания со стороны лечащего врача и самого пациента и явного принятия этого риска (зачастую для снижения риска на этапе применения используют антибиотики). При несоблюдении правил надлежащей производственной практики (GMP) нередки инфекционные осложнения [22].
Ограниченный объем донорского материала. Данный аспект особо значим в случае аутологичного донорства, когда клетки заготавливаются для собственных нужд.
Малые количества клеток требуют особо бережного и продуманного выполнения всех производственных процессов, ведь любые серьезные проблемы могут привести к порче получаемого продукта и его отбраковке. Если у пациента-донора имеется дефицит клеточного материала (ведь нередко он решает прибегнуть к клеточной терапии именно для восполнения утраченных клеток), то утрата произведенного продукта может вообще оказаться трагичной. Дефицит донорского материала также накладывает ограничения на контроль качества, поскольку ряд испытаний требует расходования клеточного препарата. Если материала мало, контроль качества может оказаться неполным, а это, в свою очередь, влечет за собой повышенные требования к валидации процесса производства — нередко ключевого компонента обеспечения качества клеточного препарата [15].
Требовательность к условиям обработки. Клетки очень чувствительны как к окружающим производственным условиям, так и методам обработки.
Будучи живыми, клетки очень восприимчивы к любым неблагоприятным воздействиям в процессе производства. Производство клеточного препарата — это комплекс манипуляций с исходным донорским материалом для придания ему желаемых новых биологических свойств или для его наращивания, чтобы получить достаточную дозу. Примеры манипуляций: обработка факторами роста, факторами дифференцировки, наращивание, генетическая модификация. Все эти процессы требуют для своего проведения строго контролируемых условий, по четко составленному, выверенному и отработанному плану, чтобы минимизировать любые отклонения.
По этой причине производство клеток должно осуществляться в соответствии с правилами надлежащей производственной практики (GMP) в асептических условиях, не допускающих внешней контаминации. Соблюдение таких условий должно быть валидировано. Достижение и поддержание таких условий должно четко контролироваться.
Невозможность исчерпывающего установления характеристик. Клетки — это сложные биологические объекты, обладающие бесчисленным множеством свойств и характеристик, некоторые из которых до сих пор не познаны.
Невозможность всесторонне охарактеризовать продукт производства означает, что он фактически определяется условиями и параметрами производства (процесс есть продукт). Следовательно, любые вариации процесса производства могут приводить к получению клеток с ранее неизвестными характеристиками, в том числе токсичными или неэффективными. Невозможность аналитически охарактеризовать клетки вынуждает сильно полагаться на результаты доклинических и клинических исследований.
Вместе с тем важно определить и отслеживать наличие (отсутствие) характеристик, имеющих решающее значение для профиля безопасности и эффективности (критичные показатели качества — CQA). В случае клеточных препаратов таковые включают жизнеспособность клеток, число клеток на дозу, степень дифференцировки и т. д. Кроме того, в сегодняшних условиях возможно определение широкого спектра генотипических и фенотипических характеристик, например с помощью секвенирования[23] генома отдельных клеток (single-cell genome sequencing) и имммунофенотипирования или современных вариантов сортировки клеток (например, флуоресцентной сортировки клеток [24]). Наконец, важно убедиться, что подвергшиеся всем запланированным манипуляциям клетки обладают требуемыми биологическими свойствами, например способностью вырабатывать биологически активные вещества, взаимодействовать с микроокружением или дифференцироваться в нужный клеточный тип.
Важность создания благоприятного микроокружения для клеток. В естественных условиях клетки находятся в очень специфическом окружении: они, как правило, связаны с соединительнотканными структурами, предоставляющими им опору, и получают различные химические и тактильные сигналы.
Для обеспечения хорошего «самочувствия» клеток и достижения целей производства нередко требуется использовать каркасы, матрицы или подложки для обеспечения 3D-структуры и физического контактирования клеток друг с другом, также может требоваться обработка клеток определенными биологически активными веществами и подбор питательных сред [25].
Некоторые клеточные препараты могут требовать соблюдения труднодостижимых условий. Например, лекарственный препарат Kymriah (тисагенлеклейцел) должен храниться при температуре −120 °C или менее, тогда как лекарственный препарат Provenge (сипулейцел-T) мог храниться всего 18 часов при температуре 2–8 °C, а Strimvelis вообще хранится только 6 часов при температуре 15–30 °C [25]. Примечательна судьба лекарственного препарата Provenge. В 2015 г. он был выведен с рынка из-за коммерческой невыгодности проекта в связи с очень дорогим производством и сложной цепью поставок. Компания Dendreon построила три крупных производственных комплекса в США, при этом стоимость расходных материалов составляла около 70% в структуре выручки при цене 93 тыс. долл. за курс лечения. Вкупе с переоцененным спросом это привело к коммерческому провалу проекта и выведению его с рынка [17].
Кроме того, децентрализация производства требует наличие высококвалифицированного персонала в достаточном количестве в том месте, где будет осуществляться деятельность, что также может накладывать ограничения на реализуемость проекта. Эти ограничения особенно значимы при попытке организации производства клеточных препаратов в больничных условиях, где создание GMP-окружения требует дополнительных крупных вложений.
Все вышеперечисленные технологические ограничения в совокупности с относительно скромными достижениями в области регенеративной медицины с использованием клеточных лекарственных препаратов (то есть препаратов, содержащих модифицированные клетки) сильно тормозят развитие клеточных технологий, хотя спрос на эти препараты очень высок и продолжает быть сильно неудовлетворенным. Вместе с решением вопросов эффективности и безопасности клеточных препаратов отрасли предстоит решить проблемы их серийного выпуска: желательно, чтобы можно было использовать стандартизированные банки аллогенных клеток для универсального применения у разных пациентов вне зависимости от иммунологической совместимости или с возможностью индивидуализации. Такие банки должны быть охарактеризованы и максимально свободны от микробных контаминантов, а условия хранения и транспортировки не должны накладывать сильных ограничений на цепи поставок.
Генные терапии
Воздействие генной терапии по определению направлено на генетический аппарат клеток человека с терапевтической или профилактической целями. Европейское и американское законодательства рассматривают генотерапевтические препараты в качестве биологических [2], [3]. Тем самым антисмысловые олигонуклеотиды (-ерсены) [26] и препараты для РНК-интерференции (-сираны), получаемые при помощи химического синтеза, к генотерапевтическим не относятся. Классификационные подходы, содержащиеся в европейском законодательстве, перешли в законодательство ЕАЭС и выражены в части IV (раздел 17) приложения №1 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения в Евразийском экономическом союзе [4].
С точки зрения того, в каких именно условиях происходит генетическая модификация, генные терапии принято разделять на препараты для модификации in vivo и препараты для модификации ex vivo. Первые — это неклеточные препараты, включающие препараты «голой» ДНК, препараты на основе невирусных векторов (например липосом), препараты на основе вирусных векторов или вирусоподобных частиц и препараты генетически модифицированных микроорганизмов (в первую очередь, бактерий). Они вводятся в организм человека с целью генетической модификации генетического материала клеток-мишеней.
При модификации ex vivo у пациента отбирают клетки, генетически модифицируют их и возвращают в организм (самого пациента-донора или других реципиентов). Помимо особенностей, присущих всем генотерапевтическим препаратам, для лекарственных препаратов на основе генетически модифицированных клеток характерны все те особенности, которые рассмотрены в отношении клеточных препаратов.
Проблемы производства и контроля качества генотерапевтических препаратов лежат в нескольких плоскостях и вызваны следующими факторами [18], [27–29]:
- Природа действующего вещества генотерапевтического лекарственного препарата. Это последовательность рекомбинантной нуклеиновой кислоты, которая непосредственно или опосредованно (после генетической модификации ex vivo) вводится в организм человека в целях регулирования, репарации, замены, добавления или удаления генетической последовательности [2]. С ней неразрывно связаны:
- неполное понимание всех генетических и эпигенетических зависимостей, которые в итоге приводят к полигенным заболеваниям (включая болезни сердечно-сосудистой системы, сахарный диабет, онкологические, нейродегенеративные и инфекционные заболевания), занимающим первые места в структуре заболеваемости и смертности, не связанной с травмами и насильственной смертью;
- уровень знаний в области молекулярной биологии, генной инженерии и смежных дисциплин.
В частности, существуют ограничения по количеству генетического материала, который за раз может быть доставлен в клетку-мишень. Это значит, что не любой ген может быть заменен или добавлен. Также существуют ограничения с точки зрения специфичности воздействия. Например, при удалении патологической генетической последовательности могут быть повреждены и здоровые участки, на которые генотерапевтический препарат не должен был бы воздействовать. Некоторые варианты добавления генов или регуляторных элементов (промоторов, энхансеров) могут приводить к сбою регулирования и непредвиденным последствиям, например избыточной транскрипции онкогенов [29]. Всё это в том числе определяется дизайном генной конструкции и генетической разработкой в целом.
- Отсутствие высокоспецифичных технологий доставки действующего вещества в клетки-мишени. Это значит, что пока не существует методов, которые могли бы с полной избирательностью доставить терапевтическую генетическую последовательность только в те клетки, которые нуждаются в генетической модификации. Внемишеневая доставка чревата различными вариантами токсичности, включая запуск канцерогенеза [29]. В этой связи важным аспектом разработки и производства становится создание подходящей и избирательной технологии доставки, которая может основываться на физических методах (например электропорации или сонопорации), химических методах (обработке поверхностно-активным веществами), носителях (липосомах) и биологических векторах (вирусах и вирусоподобных частицах).
При этом использование таких технологий доставки само по себе поднимает вопрос обеспечения их безопасности. Первые провалы применения генных терапий были связаны именно с иммуногенностью аденовирусных векторов-носителей: история Джесси Гелсингера [1] еще долго будет нависать над разработчиками этих препаратов.
Несмотря на сегодняшние достижения, всё равно не удается добиться ни полной специфичности в отношении клеток-мишеней, ни эффективной генетической модификации всех пораженных клеток. Недостаточная эффективность доставки терапевтического трансгена в целевые клетки особенно характерна для «защищенных» органов, таких как головной мозг.
Эти ограничения также требуют проведения комплекса аналитических испытаний для оценки того, в какие ткани и органы была доставлена генетическая конструкция, какова ее персистенция в организме, произошла ли интеграция в геном, каковы число копий генетической конструкции и ее идентичность, происходит ли экспрессия кодируемого генной конструкцией продукта. Вместе с тем с учетом ограничений современных аналитических технологий (чувствительности, специфичности, правильности, прецизионности, предела обнаружения и т. д.) получаемые результаты всегда приблизительны и не позволяют в полной мере охарактеризовать все происходящие в организме процессы.
Необходимость использования вирусных векторов. Сегодня это наиболее эффективный метод доставки генетического материала. Основные опасения при использовании большинства известных типов вирусных векторов — спонтанное восстановление вирулентности (например, если используются аденовирусные, герпесвирусные или ретровирусные векторы), потенциал беспорядочной интеграции (ретровирусов), а также недостаточная очистка от различных вирусов-контаминантов (например, от аденовирусов в случае аденоассоциированных вирусов). Кроме того, использование вирусных векторов чревато острым иммунным ответом — цитокиновым штормом[1].
Вследствие иммуногенности к вирусным векторам возможность их повторного использования ограничена, поэтому большинство генотерапевтических препаратов предназначено для однократного введения [27]. Если требуется неоднократное введение, необходимо продумать создание альтернативных систем доставки, что, по сути, предполагает создание нового лекарственного препарата с необходимостью полной характеристики его безопасности, эффективности, контроля производства и контроля качества.
В остальном получение и контроль качества генотерапевтических препаратов очень похожи на получение рекомбинантных белков [27]. Процесс получения предусматривает использование одного или нескольких процессов культивирования. Если используются невирусные методы доставки, то достаточно произвести только последовательность ДНК, как правило, с помощью E. coli. В случае же вирусных векторов необходимо также произвести вирусоподобные частицы или полноценные вирусные векторы. Это достигается использованием так называемых пакующих клеточных линий. Если вирусный вектор нуждается в помощнике, то может потребоваться производство вируса-помощника на клеточной линии, предназначенной для этого.
Если генотерапевтическим лекарственным препаратом являются генетически модифицированные (ГМ) клетки (например, CAR-T, ГМ-макрофаги [30], ГМ-NK-клетки [31]), то учитываются как особенности клеточных препаратов, так и бесклеточных генотерапевтических.
Ввиду сложности процессов производства, очень ограниченных возможностей по очистке от всевозможных примесей (в том числе, к примеру, не подвергшихся генетической модификации клеток, клеток других типов, присутствующих в образце) и инактивации микробных контаминантов, единственным действенным инструментом контроля качества препарата является правильно спланированный, всесторонне охарактеризованный процесс, который подвергся полноценной валидации. Валидация процесса производства предполагает подтверждение того, что итогом процесса производства станет лекарственный препарат требуемого качества. Для этого процесс повторяют много раз и всесторонне устанавливают характеристики входных материалов, промежуточных продуктов производства и конечного препарата. В итоге нужно подтвердить, что выбранные параметры процесса производства в должной мере отвечают цели, сформулированной во время разработки препарата [27].
Пример производства генной терапии
Разберем на примере генотерапевтического препарата Luxturna (воретигена непарвовек), зарегистрированного FDA в 2017 году для лечения одного из видов наследственной дистрофии сетчатки, как устроен процесс производства препарата и какие требования предъявляет к нему FDA. О самом препарате можно прочесть в предыдущей статье нашего цикла
Для получения лекарственного вещества — рекомбинантного аденоассоциированного вируса, содержащего терапевтический ген, — используются клетки почки человеческого эмбриона HEK293. Клетки клеточной линии HEK293 осуществляют биосинтез как терапевтического гена, так и компонентов системы доставки — вирусного вектора. Для этого их трансдуцируют тремя плазмидами, содержащими:
- экспрессионную кассету белка RPE65 (дефектного у пациентов);
- последовательности, кодирующие белки капсида вирусного вектора AAV2;
- последовательности вируса-помощника, упаковывающие кассету RPE65 в рекомбинантные частицы AAV2 (рис. 3).
Такой подход позволяет избежать использования живого вируса-помощника в процессе производства, что очень важно, ведь обычные методы удаления и инактивации вирусов невозможно применить к продукту на основе вирусного вектора.
Рисунок 3. Схема производства частиц AAV с терапевтическим геном
После культивирования в реакторе клетки собирают, подвергают фильтрации и катионообменной хроматографии. Затем препарат центрифугируют в градиенте плотности и еще раз фильтруют.
В публичном экспертном отчете FDA подробно описаны шаги производственного процесса, исходные материалы (банк клеток, плазмиды), приведены их спецификации и методы контроля. Характерно, что и до, и после подачи заявления на одобрение для продажи (в США она в случае биологических продуктов называется заявлением на лицензирование биопрепарата — biologics license application, BLA) FDA принимала очень активное участие в процессе, запрашивая у компании Spark множество уточнений и заставляя доделывать недостающие аспекты производства. Так, оказалось, что у компании были проблемы с обеспечением постоянства содержания одного из вспомогательных веществ в финальном продукте, однако после замечания FDA проблема была устранена.
Для всех стадий процесса были идентифицированы критичные параметры, критичные методы внутрипроизводственного контроля и диапазоны приемлемых значений. Затем была проведена валидация производственного процесса на одной серии продукта, произведенной в промышленном масштабе.
Продукт для клинических исследований производился на базе Филадельфийского детского госпиталя, а для коммерческого производства — на мощностях частной фирмы. Компания Spark провела исследования сопоставимости продуктов, полученных с помощью разных процессов производства, для доказательства того, что смена места производства не сказалась негативным образом на характеристиках безопасности и эффективности.
Директор компании в интервью рассказал, что досье для подачи BLA заняло 60 000 страниц, причем бóльшая часть объема была посвящена именно производству и методам его контроля. Компания разработала 41 испытание для оценки конечного продукта. Через два года после одобрения компания смогла перейти на биореакторы объемом 400 литров: это было непросто, так как нужно было научиться выращивать клетки в объеме, а не только в пристеночном слое. Теперь открылись возможности для масштабного производства генной терапии, что необходимо для более распространенных заболеваний.
Проблемы регулирования
Несмотря на то что идеи использования клеточных и генных препаратов в терапевтических целях не новы и насчитывают несколько десятилетий, более-менее систематическое их применение началось относительно недавно, и им еще только предстоит войти в основной арсенал используемых медицинских технологий.
Регуляторные требования, которые должны приниматься во время разработки, производства и контроля качества генотерапевтических и клеточных препаратов, учитывают различные особенности передовых терапий, риски и тяжесть их последствий. В частности, помимо упомянутого выше многоуровневого контроля микробиологических рисков, в отношении генотерапевтических препаратов действует отдельная отрасль законодательства в области генетически модифицированных организмов. Для оценки его соблюдения в Евросоюзе, к примеру, сформирована и действует отдельная система регулирования, отличная от системы регулирования лекарств [32–35]. Удовлетворение этих требований дополнительно осложняет разработку и производство генотерапевтических препаратов [36].
Беспрецедентными являются и меры контроля за препаратами передовой терапии после их введения пациенту. В ЕС наблюдение за такими пациентами должно длиться по меньшей мере 30 лет. Кроме того, должна быть обеспечена полная прослеживаемость от исходных материалов (например донорских клеток), до индивидуальных доз и далее до конкретных пациентов, и в обратном направлении, чтобы можно было однозначно идентифицировать «виновные» дозы и исходные материалы, если у пациента что-то пойдет не так, даже, к примеру, 25 лет спустя.
Регуляторные стандарты безопасности и эффективности препаратов передовой терапии, часть из которых воплощается в требованиях к производству и контролю качества, а также нередко индивидуальный характер разработок, делает их очень дорогими. Тем самым исследователи находятся под постоянным финансовым прессом из-за ограниченности ресурсов. С другой стороны, это вынуждает искать более экономичные методы разработки и миниатюризации производства, а также максимального приближения производственных мощностей к пациенту с целью экономии на транспортировке и хранении.
С экономическими аспектами тесно связана возможность воспроизведения препаратов для передовой терапии, которую целесообразно рассматривать с разных позиций, в том числе с точки зрения технической реализуемости, регуляторной реализуемости, экономической целесообразности, интеллектуальных прав и т. д. В целом движущая сила разработки воспроизведенных препаратов — возможность ценовой конкуренции с инновационным препаратом за счет экономии на разработке. Экономия на разработке исходит из ненужности повторения обширных доклинических и клинических исследований, которые были проведены разработчиком оригинального препарата, при условии того, что материальный носитель лекарственного препарата воспроизведен во всех критичных аспектах.
На сегодняшний день проблема воспроизведения клеточных препаратов и сложных генотерапевтических препаратов на основе вирусных векторов — задача труднореализуемая. Она требует приобретения образцов оригинального препарата, обратную инженерию его состава и структуры и дальнейшие масштабные лабораторные испытания для оценки успешности воспроизведения, прежде чем прототип будет готов к доклиническим и клиническим исследованиям. Уже на этом этапе разработчик столкнется со сложностями, поскольку образцы оригинального препарата могут быть запредельно дорогими, а в ряде случаев изготавливаться по индивидуальному заказу. Что касается трудностей воспроизведения таких сложных материальных объектов как вирусные векторы или живые клетки человека, следует отметить, что на сегодняшний день не воспроизводятся даже «простые» ферменты или факторы свертывания крови, которые, будучи сложнее моноклональных антител, тем не менее, гораздо проще по строению препаратов передовой терапии.
К техническим сложностям, которые сами по себе решаемы в долгосрочной перспективе, добавляются сложности научно-регуляторного характера. Нынешние препараты передовой терапии, как правило, предназначены для лечения редких заболеваний. Чтобы статистически подтвердить эквивалентность воспроизводимого препарата инновационному, в случае биопрепаратов, как правило, требуется выполнить сравнительные клинические исследования. Выборка для подтверждения эквивалентной эффективности может быть очень большой, достигая сотен человек, что для орфанных заболеваний может быть достаточно проблематично. Кроме того, обеспечение пациентов оригинальным препаратом тоже внесет большую лепту в стоимость исследования. В этом ключе гораздо дешевле и быстрее может оказаться разработка аналога с некоторыми второстепенными отличиями от оригинала, нежели полное воспроизведение [37–39]. Например, клиническая программа разработки аналогов рекомбинантных ферментов для лечения орфанных заболеваний или факторов свертывания крови обычно достаточно сжатая, требует всего несколько десятков пациентов и может даже не требовать сопутствующего сравнения с оригинальным препаратом. В этой связи гораздо важнее может быть воспроизведение терапевтического результата, а не самого лекарственного препарата.
Проблемы регулирования и производства генных и клеточных продуктов в России
Проблемы регулирования и производства генных и клеточных продуктов в России (рис. 4) обусловлены как общим отставанием в развитии фармацевтической отрасли и подходов к ее регулированию от ведущих зарубежных юрисдикций, так и специфичными проблемами, присущими именно этой области разработки, производства, изучения и регулирования терапевтических продуктов. Здесь мы остановимся только на специфичных проблемах.
Рисунок 4. Схематическое представление основных проблем, затрудняющих вывод клеточных препаратов на рынок в России
Основная проблема, трудно устранимая в кратко- и среднесрочной перспективе, — дефицит кадров. Эта сфера остро нуждается в биотехнологических и биохимических инженерах, специалистах в области биомедицинского анализа и визуализации, генетиках, фармацевтических микробиологах, специалистах в областях системной и вычислительной биологии, механики жидкостей, микрофлюидики и вычислительной динамики жидкостей. В нашей стране таких специалистов очень мало, а вузовские программы сильно отстают от ведущих мировых программ.
Следующим ограничением является дороговизна создания и поддержания производственных мощностей для производства клеточных препаратов, в которых должны соблюдаться строжайшие требования к асептическому производству, постоянству окружающих условий, разделению потоков производимых препаратов, специальным методам очистки и т. д. В случае индивидуализированных препаратов, например таких, как CAR-T, порой, весь производственный цикл осуществляется ради получения одной дозы для одного пациента. Точно так же выполняемый во время производства и по его завершении комплекс аналитических испытаний для оценки качества препарата на различных стадиях его получения реализуется для одной дозы или относительно небольшого их числа.
Не решены проблемы в области донорства и заготовки клеток, оценки и минимизации рисков при использовании генетически модифицированных организмов. Для ряда разрабатываемых препаратов в стране отсутствуют высокотехнологичные лаборатории, оснащение которых позволяло бы проводить широкий спектр испытаний на рецепторах, отдельных клетках, тканях и крупных животных (например, собаках, минипигах, нечеловекообразных приматах и др.), которые бы отвечали международным требованиям по обеспечению достоверности научных данных и гуманному обращению с животными.
Наконец, локальное законодательство в области генных и клеточных препаратов неупорядоченное и противоречивое. Отсутствует единое восприятие и отношение к ним как к подгруппе лекарственных препаратов, требующих дополнительных методов обеспечения безопасности, эффективности и качества. Основная проблема сегодняшней регуляторики этой сферы — отсутствие гармонизации с зарубежными подходами, требованиями и даже определениями. В частности, не выработаны частные критерии, предъявляемые к условиям и параметрам производства, оцениваемым показателям качества, целям, разновидностям и объему доклинических и клинических исследований в зависимости от вида разрабатываемого препарата, его терапевтического назначения и рисков для пациентов. Отсутствие специальных критериев для препаратов генной и клеточной терапий усложняет проведение исследований в полном объеме. Вместе с тем регуляторные проблемы — наименее сложные (их можно решить несколькими приказами Минздрава, тогда как, например, проблему недостатка кадров решить гораздо сложнее), поскольку сейчас ничто не мешает разработчикам ориентироваться на зарубежные требования, которые, пусть и обширны, но упорядочены и помогают сориентироваться в сложном процессе изысканий, разработки и проведения испытаний и исследований.
Мнение эксперта
Интервью Павла Гершовича «Биомолекуле»
Рисунок 5. Павел Гершович
Павел Гершович — директор Департамента разработки генотерапевтических препаратов компании BIOCAD, кандидат биологических наук, и.о. директора Научно-образовательного центра технологии рекомбинантных белков СПХФУ.
В компании BIOCAD Павел курирует работу по созданию генной терапии для лечения гемофилии, спинальной мышечной атрофии и других тяжелых наследственных заболеваний.
«Биомолекула»: Какова, по вашему опыту, трудоемкость процесса производства клеточных или генотерапевтических препаратов в расчете на дозу в сравнении с биотехнологическими белками?
Павел Гершович: Трудоемкость производства генотерапевтических и клеточных препаратов сильно варьирует в зависимости от природы генетического вектора и расчетной дозы препарата для введения пациенту. В сравнении с рекомбинантными белками, в том числе антителами, в среднем трудоемкость процесса пока остается значительно выше. Увеличение количества стадий производства неминуемо влечет за собой дополнительные трудозатраты. Это обусловлено тем, что для производства генотерапевтических лекарственных препаратов, или БМКП (биомедицинских клеточных продуктов — термин из российского законодательства; прим. ред.), используются генетические векторы различной природы, являющиеся полупродуктами финального биотехнологического процесса.
«БМ»: Рассматриваете ли вы децентрализацию производства как один из подходов для удешевления производства за счет приближения лекарства к пациенту?
ПГ: Децентрализация производства актуальна далеко не для всех генно-клеточных видов терапии. Такой подход может сильно упростить производство и клиническое применение большинства типов аутологичной передовой терапии, таких как БМКП для регенеративной медицины и CAR-T-терапии онкологических заболеваний. В системе производства, где пациент является единственным донором исходного материала и реципиентом конечного продукта, масштаб производства не имеет решающего значения. Если биомедицинская технология работает «у постели больного», это существенно сокращает затраты на производство и выводит доступность терапии на новый уровень. К сожалению, в нашей стране законодательство пока не позволяет в полной мере реализовать такую концепцию, что практически лишает шансов на выздоровление многих тяжело больных пациентов.
«БМ»: Какие регуляторные изменения компания хотела бы видеть в России?
ПГ: Гармонизация регуляторных требований по отношению ко всем видам препаратов передовой терапии на текущий момент является основой задачей. Мы имеем возможность анализировать и использовать накопленный опыт зарубежных коллег, чтобы создать все условия для роста и развития этой инновационной области фармацевтики в нашей стране.
«БМ»: Насколько российские практики производства, контроля качества отличаются от зарубежных? Насколько «Биокад» опирается на зарубежный опыт?
ПГ: «Биокад» неукоснительно соблюдает все требования регулятора, действующие на территории России. При этом мы придерживаемся стандартов качества, принятых на так называемых высоко регулируемых рынках. Производство любых типов лекарственных препаратов — это не статический процесс, а постоянное движение к совершенствованию технологических решений и системы контроля качества продукта, за которым стоит ежедневный кропотливый труд сотен специалистов.
Материал предоставлен партнёром — Департаментом разработки генотерапевтических препаратов компании BIOCAD
Заключение
Генные и клеточные терапии вносят пока незначительный общий вклад в арсенал терапевтических средств, уступая как низкомолекулярным лекарствам, так и рекомбинантным белкам. Однако эта область фармакологии активно развивается, следуя за научным прогрессом как в дисциплинах, лежащих в ее основе, так и в области производства и индивидуализации этих продуктов. Зарубежные регуляторы активно поддерживают развивающуюся отрасль, обобщая и формализуя свои рекомендации в виде научных и регуляторных руководств, направленных на систематизацию стратегии разработки, но с учетом индивидуальных особенностей новых препаратов, а также активно предлагают научные консультации, чтобы помочь компаниям выбрать наиболее оправданные пути продвижения вперед. Также у FDA и EMA есть специальных статусы для генотерапевтических и клеточных продуктов — например RMAT (Regenerative Medicine Advanced Therapy) у FDA, которые позволяют ускорить разработку продуктов и облегчить взаимодействие с агентствами.
В России некоторое улучшение регуляторной ситуации в области разработки лекарств ожидается с переходом на законодательство Евразийского экономического союза, которое во многих аспектах повторяет законодательство Евросоюза. В частности, есть надежда, что клеточная терапия будет регламентироваться не по закону 180-ФЗ, как «биомедицинские клеточные продукты», а как лекарства.
В будущем с точки зрения производства и контроля качества события будут развиваться в двух в определенной мере противоположных направлениях. Будут прорабатываться методы крупномасштабного производства препаратов, предназначенных для лечения распространенных заболеваний. Параллельно будут развиваться подходы индивидуализированного производства для получения препаратов под нужды конкретных пациентов.
В следующей статье цикла мы расскажем подробнее о клеточных терапиях, в первую очередь, конечно, о Т-клетках с химерным антигенным рецептором (CAR-T).
Источник статьи: http://biomolecula.ru/articles/gennye-i-kletochnye-lekarstva-slozhnoe-regulirovanie-dlia-slozhnykh-produktov
ALLHORMON.NAROD.RU
Все о гормона — сайт посвященные эндокринной системе человека.
Механизм действия
В настоящее время различают следующие варианты действия гормонов:
- гормональное, или гемокринное, т.е. действие на значительном удалении от места образования;
- изокринное, или местное, когда химическое вещество, синтезированное в одной клетке, оказывает действие на клетку, расположенную в тесном контакте с первой, и высвобождение этого вещества осуществляется в межтканевую жидкость и кровь;
- нейрокринное, или нейроэндокринное (синаптическое и несинаптическое), действие, когда гормон, высвобождаясь из нервных окончаний, выполняет функцию нейротрансмиттера или нейромодулятора, т.е. вещества, изменяющего (обычно усиливающего) действие нейротрансмиттера;
- паракринное — разновидность изокринного действия, но при этом гормон, образующийся в одной клетке, поступает в межклеточную жидкость и влияет на ряд клеток, расположенных в непосредственной близости;
- юкстакринное – разновидность паракринного действия, когда гормон не попадает в межклеточную жидкость, а сигнал передается через плазматическую мембрану рядом расположенной другой клетки;
- аутокринное действие, когда высвобождающийся из клетки гормон оказывает влияние на ту же клетку, изменяя ее функциональную активность;
- солинокринное действие, когда гормон из одной клетки поступает в просвет протока и достигает таким образом другой клетки, оказывая на нее специфическое воздействие (например, некоторые желудочно-кишечные гормоны).
Синтез белковых гормонов, как и других белков, находится под генетическим контролем, и типичные клетки млекопитающих экспрессируют гены, которые кодируют от 5000 до 10 000 различных белков, а некоторые высокодифференцированные клетки – до 50 000 белков. Любой синтез белка начинается с транспозиции сегментов ДНК, затем транскрипции, посттранскрипционного процессинга, трансляции, посттрансляционного процессинга и модификации. Многие полипептидные гормоны синтезируются в форме больших предшественников — прогормонов (проинсулин, проглюкагон, проопиомеланокортин и др.). Конверсия прогормонов в гормоны осуществляется в аппарате Гольджи.
- Существуют два основных механизма действия гормонов на уровне клетки:
1)Реализация эффекта с наружной поверхности клеточной мембраны
В этом случае рецепторы расположены на мембране клетки. В результате взаимодействия гормона с рецептором активируется мембранный фермент — аденилатциклаза. Этот фермент способствует образованию из аденозинтрифосфорнои кислоты (АТФ) важнейшего внутриклеточного посредника реализации гормональных эффектов — циклического 3,5-аденозинмонофосфата (цАМФ). цАМФ активирует клеточный фермент протеинкиназу, реализующую действие гормона. Установлено, что гормоно-зависимая аденилатциклаза — это общий фермент, на который действуют различные гормоны, в то время как рецепторы гормонов множественны и специфичны для каждого гормона. Вторичными посредниками кроме цАМФ могут быть циклический 3,5-гуанозинмонофосфат (цГМФ), ионы кальция, инозитол-трифосфат. Так действуют пептидные, белковые гормоны, производные тирозина — катехоламины. Характерной особенностью действия этих гормонов является относительная быстрота возникновения ответной реакции, что обусловлено активацией предшествующих уже синтезированных ферментов и других белков.
Гормоны осуществляют свое биологическое действие, комплексируясь с рецепторами – информационными молекулами, трансформирующими гормональный сигнал в гормональное действие. Большинство гормонов взаимодействуют с рецепторами, расположенными на плазматических мембранах клеток, а другие гормоны – с рецепторами, локализованными внутриклеточно, т.е. с цитоплазматическими и ядерными.
Плазматические рецепторы в зависимости от структуры подразделяются на:
- рецепторы, трансмембранный сегмент которых состоит из семи фрагментов (петель);
- рецепторы, трансмембранный сегмент которых состоит из одного фрагмента (петли или цепи);
- рецепторы, трансмембранный сегмент которых состоит из четырех фрагментов (петель).
К гормонам, рецептор которых состоит из семи трансмембранных фрагментов, относятся:
АКТГ, ТТГ, ФСГ, ЛГ, хорионический гонадотропин, простагландины, гастрин, холецистокинин, нейропептид Y, нейромедин К, вазопрессин, адреналин (a-1 и 2, b-1 и 2), ацетилхолин (М1, М2, М3 и М4), серотонин (1А, 1В, 1С, 2), дофамин (Д1 и Д2), ангиотензин, вещество К, вещество Р, или нейрокинин 1, 2 и 3 типа, тромбин, интерлейкин-8, глюкагон, кальцитонин, секретин, соматолиберин, ВИП, гипофизарный аденилатциклазактивирующий пептид, глютамат (MG1 – MG7), аденин.
Ко второй группе относятся гормоны, имеющие один трансмембранный фрагмент:
СТГ, пролактин, инсулин, соматомаммотропин, или плацентарный лактоген, ИФР-1, нервные факторы роста, или нейротрофины, фактор роста гепатоцитов, предсердный натрийуретический пептид типа А, В и С, онкостатин, эритропоэтин, цилиарный нейротрофический фактор, лейкемический ингибиторный фактор, фактор некроза опухолей (р75 и р55), нервный фактор роста, интерфероны (a, b и g), эпидермальный фактор роста, нейродифференцирующий фактор, факторы роста фибробластов, факторы роста тромбоцитов А и В, макрофагный колониестимулирующий фактор, активин, ингибин, интерлейкины-2, 3, 4, 5, 6 и 7, гранулоцито-макрофагный колониестимулирующий фактор, гранулоцитный колониестимулирующий фактор, липопротеин низкой плотности, трансферрин, ИФР-2, урокиназный плазминогенный активатор.
К гормонам третьей группы, рецептор которых имеет четыре трансмембранных фрагмента, относятся:
ацетилхолин (никотиновые мышечные и нервные), серотонин, глицин, g-аминомасляная кислота.
Cопряжение рецептора с эффекторными системами осуществляется через так называемый G-белок, функция которого заключается в обеспечении многократного проведения гормонального сигнала на уровне плазматической мембраны. G-белок в активированной форме стимулирует через аденилатцик-лазу синтез циклического АМФ, который запускает каскадный механизм активирования внутриклеточных белков.
Общим фундаментальным механизмом, посредством которого реализуются биологические эффекты «вторичных» мессенджеров внутри клетки, является процесс фосфорилирования – дефосфорилирования белков при участии широкого разнообразия протеинкиназ, катализирующих транспорт концевой группы от АТФ на ОН-группы серина и треонина, а в ряде случаев – тирозина белков-мишеней. Процесс фосфорилирования представляет собой важнейшую посттрансляционную химическую модификацию белковых молекул, коренным образом изменяющую как их структуру, так и функции. В частности, он вызывает изменение структурных свойств (ассоциацию или диссоциацию составляющих субъединиц), активирование или ингибирование их каталитических свойств, в конечном итоге определяя скорость химических реакций и в целом функциональную активность клеток.
Аденилатциклазная мессенджерная система
Наиболее изученным является аденилатциклазный путь передачи гормонального сигнала. В нем задействовано мимимум пять хорошо изученных белков:
1)рецептор гормона;
2)фермент аденилатциклаза, выполняющая функцию синтеза циклического АМФ (цАМФ);
3)G-белок, осуществляющий связь между аденилатциклазой и рецептором;
4)цАМФ-зависимая протеинкиназа, катализирующая фосфорилирование внутриклеточных ферментов или белков-мишеней, соответственно изменяя их активность;
5)фосфодиэстераза, которая вызывает распад цАМФ и тем самым прекращает (обрывает) действие сигнала
Показано, что связывание гормона с β-адренергическим рецептором приводит к структурным изменениям внутриклеточного домена рецептора, что в свою очередь обеспечивает взаимодействие рецептора со вторым белком сигнального пути – ГТФ-связывающим.
ГТФ-связывающий белок – G-белок – представляет собой смесь 2 типов белков:
активного Gs(от англ. stimulatory G)
ингибиторного Gi
В составе каждого из них имеется три разные субъединицы (α-, β- и γ-), т.е. это гетеротримеры. Показано, что β-субъединицы Gs и Gi идентичны; в то же время α-субъединицы, являющиеся продуктами разных генов, оказались ответственными за проявление G-белком активаторной и ингибиторной активности. Гормонрецепторный комплекс сообщает G-белку способность не только легко обменивать эндогенный связанный ГДФ на ГТФ, но и переводить Gs-белок в активированное состояние, при этом активный G-белок диссоциирует в присутствии ионов Mg 2+ на β-, γ-субъединицы и комплекс α-субъединицы Gs в ГТФ-форме; этот активный комплекс затем перемещается к молекуле аденилатциклазы и активирует ее. Сам комплекс затем подвергается самоинактивации за счет энергии распада ГТФ и реассоциации β- и γ-субъединиц с образованием первоначальной ГДФ-формы Gs.
Аденилатциклазный путь передачи гормонального сигнала.
Рец — рецептор; G — G-белок; АЦ-аденилатциклаза.
Аденилатциклаза представляет собой интегральный белок плазматических мембран, его активный центр ориентирован в сторону цитоплазмы и катализирует реакцию синтеза цАМФ из АТФ:
Каталитический компонент аденилатциклазы, выделенный из разных тканей животных, представлен одним полипептидом. В отсутствие G-белков он практически неактивен. Содержит две SH-группы, одна из которых вовлечена в сопряжение с Gs-белком, а вторая необходима для проявления каталитической активности.Под действием фосфоди-эстеразы цАМФ гидролизуется с образованием неактивного 5′-АМФ.
Протеинкиназа – это внутриклеточный фермент, через который цАМФ реализует свой эффект. Протеинкиназа может существовать в 2 формах. В отсутствие цАМФ протеинкиназа представлена в виде тетрамерного комплекса, состоящего из двух каталитических (С2) и двух регуляторных (R2) субъединиц; в этой форме фермент неактивен. В присутствии цАМФ протеинкиназный комплекс обратимо диссоциирует на одну R2-субъединицу и две свободные каталитические субъединицы С; последние обладают ферментативной активностью, катализируя фосфорилирование белков и ферментов, соответственно изменяя клеточную активность.
Структура протеинкиназы
Активность многих ферментов регулируется цАМФ-зависимым фосфорилированием, соответственно большинство гормонов белково-пептидной природы активирует этот процесс. Однако ряд гормонов оказывает тормозящий эффект на аденилатциклазу, соответственно снижая уровень цАМФ и фосфорилирование белков. В частности, гормон соматостатин, соединяясь со своим специфическим рецептором – ингибиторным G-белком (Gi , являющимся структурным гомологом Gs-белка), ингибирует аденилатциклазу и синтез цАМФ, т.е. вызывает эффект, прямо противоположный вызываемому адреналином и глюкагоном. В ряде органов простагландины (в частности, РGЕ1) также оказывают ингибиторный эффект на аденилатциклазу, хотя в том же органе (в зависимости от типа клеток) и тот же PGE1 может активировать синтез цАМФ.
Более подробно изучен механизм активирования и регуляции мышечной гликогенфосфорилазы, активирующей распад гликогена. Выделяют 2 формы:
каталитически активную – фосфорилаза а и
неактивную – фосфорилаза b.
Обе фосфорилазы построены из двух идентичных субъединиц, в каждой остаток серина в положении 14 подвергается процессу фосфорилирования–дефосфорилирования, соответственно активированию и инактивированию.
Ковалентная регуляция гликогенфосфорилазы.
Под действием киназы фосфорилазы b, активность которой регулируется цАМФ-зависимой протеинкиназой, обе субъединицы молекулы неактивной формы фосфорилазы b подвергаются ковалентному фосфорилиро-ванию и превращаются в активную фосфорилазу а. Дефосфорилирование последней под действием специфической фосфатазы фосфорилазы а приводит к инактивации фермента и возврату в исходное состояние.
В мышечной ткани открыты 3 типа регуляции гликогенфосфорилазы.
Первый тип – ковалентная регуляция, основанная на гормонзависимом фосфорилировании–дефосфорилировании субъединиц фосфорилазы.
Второй тип – аллостерическая регуляция. Она основана на реакциях аденилирования–деаденилирования субъединиц гликогенфосфорилазы b (соответственно активирование–инактивирование). Направление реакций определяется отношением концентраций АМФ и АТФ, присоединяющихся не к активному центру, а к аллостерическому центру каждой субъединицы.
Аллостерическая регуляция гликогенфосфорилазы.
В работающей мышце накопление АМФ, обусловленное тратой АТФ, вызывает аденилирование и активирование фосфорилазы b. В покое, наоборот, высокие концентрации АТФ, вытесняя АМФ, приводят к аллостерическому ингибированию этого фермента путем деаденилирования.
Третий тип – кальциевая регуляция, основанная на аллостерическом активировании киназы фосфорилазы b ионами Са 2+ , концентрация которых повышается при мышечном сокращении, способствуя тем самым образованию активной фосфорилазы а.
Гуанилатциклазная мессенджерная система
Довольно долгое время циклический гуанозинмонофосфат (цГМФ) рассматривался как антипод цАМФ. Ему приписывали функции, противоположные цАМФ. К настоящему времени получено много данных, что цГМФ принадлежит самостоятельная роль в регуляции функции клеток. В частности, в почках и кишечнике он контролирует ионный транспорт и обмен воды, в сердечной мышце служит сигналом релаксации и т.д.
Биосинтез цГМФ из ГТФ осуществляется под действием специфической гуанилатциклазы по аналогии с синтезом цАМФ:
Схематическое выражение центральной роли цАМФ и протеинкиназы в гормональной регуляции синтеза и распада гликогена.
Адреналинрецепторный комплекс: АЦ — аденилатциклаза, G — G-белок; С и R — соответственно каталитические и регуляторные субъединицы протеинкиназы; КФ — киназа фосфорилазы b; Ф — фосфорилаза; Глк-1-P — глюкозо-1-фосфат; Глк-6-P — глюкозо-6-фосфат; УДФ-Глк — уридиндифосфатглюкоза; ГС — гликогенсинтаза.
Известны четыре разные формы гуанилатциклазы, три из которых являются мембраносвязанными и одна – растворимая открыта в цитозоле.
Мембраносвязанные формы состоят из 3 участков:
рецепторного, локализованного на внешней поверхности плазматической мембраны;
внутримембранного домена и
каталитического компонента, одинакового у разных форм фермента.
Гуанилатциклаза открыта во многих органах (сердце, легкие, почки, надпочечники, эндотелий кишечника, сетчатка и др.), что свидетельствует о широком ее участии в регуляции внутриклеточного метаболизма, опосредованном через цГМФ. Мембраносвязанный фермент активируется через соответствующие рецепторы короткими внеклеточными пептидами, в частности гормоном предсердным натрийуретическим пептидом (АНФ), термостабильным токсином грамотрицательных бактерий и др. АНФ, как известно, синтезируется в предсердии в ответ на увеличение объема крови, поступает с кровью в почки, активирует гуанилатциклазу (соответственно повышает уровень цГМФ), способствуя экскреции Na и воды. Гладкие мышечные клетки сосудов также содержат аналогичную рецептор-гуанилатциклазную систему, посредством которой связанный с рецептором АНФ оказывает сосудорасширяющее действие, способствуя снижению кровяного давления. В эпителиальных клетках кишечника активатором рецептор–гуанилатциклазной системы может служить бактериальный эндотоксин, который приводит к замедлению всасывания воды в кишечнике и развитию диареи.
Растворимая форма гуанилатциклазы является гемсодержащим ферментом, состоящим из 2 субъединиц. В регуляции этой формы гуанилатциклазы принимают участие нитровазодилататоры, свободные радикалы – продукты перекисного окисления липидов. Одним из хорошо известных активаторов является эндотелиальный фактор (EDRF), вызывающий релаксацию сосудов. Действующим компонентом, естественным лигандом, этого фактора служит оксид азота NO. Эта форма фермента активируется также некоторыми нитрозовазодилататорами (нитроглицерин, нитропруссид и др.), используемыми при болезнях сердца; при распаде этих препаратов также освобождается NO.
Оксид азота образуется из аминокислоты аргинина при участии сложной Са 2+ -зависимой ферментной системы со смешанной функцией, названной NO-синтазой:
Оксид азота при взаимодействии с гемом гуанилатциклазы способствует быстрому образованию цГМФ, который снижает силу сердечных сокращений путем стимулирования ионных насосов, функционирующих при низких концентрациях Са 2+ . Однако действие NO кратковременное, несколько секунд, локализованное – вблизи места его синтеза. Подобный эффект, но более длительный оказывает нитроглицерин, который медленнее освобождает NO.
Получены доказательства, что большинство эффектов цГМФ опосредовано через цГМФ-зависимую протеинкиназу, названную протеинкина-зой G. Этот широко распространенный в эукариотических клетках фермент получен в чистом виде. Он состоит из 2 субъединиц – каталитического домена с последовательностью, аналогичной последовательности С-субъединицы протеинкиназы А (цАМФ-зависимой), и регуля-торного домена, сходного с R-субъединицей протеинкиназы А. Однако протеинкиназы А и G узнают разные последовательности белков, регулируя соответственно фосфорилирование ОН-группы серина и треонина разных внутриклеточных белков и оказывая тем самым разные биологические эффекты.
Уровень циклических нуклеотидов цАМФ и цГМФ в клетке контролируется соответствующими фосфодиэстеразами, катализирующими их гидролиз до 5′-нуклеотидмонофосфатов и различающимися по сродству к цАМФ и цГМФ. Выделены и охарактеризованы растворимая кальмоду-линзависимая фосфодиэстераза и мембраносвязанная изоформа, не регулируемая Са 2+ и кальмодулином.
Са 2+ -мессенджерная система
Ионам Са 2+ принадлежит центральная роль в регуляции многих клеточных функций. Изменение концентрации внутриклеточного свободного Са 2+ является сигналом для активации или ингибирования ферментов, которые в свою очередь регулируют метаболизм, сократительную и секреторную активность, адгезию и клеточный рост. Источники Са 2+ могут быть внутри- и внеклеточными. В норме концентрация Са 2+ в цитозоле не превышает 10 -7 М, и основными источниками его являются эндоплазматический ретикулум и митохондрии. Нейрогормональные сигналы приводят к резкому повышению концентрации Са 2+ (до 10 –6 М), поступающего как извне через плазматическую мембрану (точнее, через потенциалзависимые и рецепторзависимые кальциевые каналы), так и из внутриклеточных источников. Одним из важнейших механизмов проведения гормонального сигнала в кальций–мессенджерной системе является запуск клеточных реакций (ответов) путем активирования специфической Са 2+ -кальмодулин-зависимой протеинкиназы. Регуляторной субъединицей этого фермента оказался Са 2+ -связывающий белок кальмодулин. При повышении концентрации Са 2+ в клетке в ответ на поступающие сигналы специфическая протеинкиназа катализирует фосфорилирование множества внутриклеточных ферментов – мишеней, регулируя тем самым их активность. Показано, что в состав киназы фосфорилазы b, активируемой ионами Са 2+ , как и NO-синтазы, входит кальмодулин в качестве субъединицы. Кальмодулин является частью множества других Са 2+ -связывающих белков. При повышении концентрации кальция связывание Са 2+ с кальмодулином сопровождается конформационными его изменениями, и в этой Са 2+ -связанной форме кальмодулин модулирует активность множества внутриклеточных белков (отсюда его название).
К внутриклеточной системе мессенджеров относят также производные фосфолипидов мембран эукариотических клеток, в частности фосфорилированные производные фосфатидилинозитола. Эти производные освобождаются в ответ на гормональный сигнал (например, от вазопрессина или тиротропина) под действием специфической мембраносвязанной фосфолипазы С. В результате последовательных реакций образуются два потенциальных вторичных мессенджера – диацилглицерол и инозитол-1,4,5-трифосфат.
Биологические эффекты этих вторичных мессенджеров реализуются по-разному. Действие диацилглицерола, как и свободных ионов Са 2+ , опосредовано через мембраносвязанный Са-зависимый фермент протеинкиназу С, которая катализирует фосфорилирование внутриклеточных ферментов, изменяя их активность. Инозитол-1,4,5-трифосфат связывается со специфическим рецептором на эндоплазматическом ретикулуме, способствуя выходу из него ионов Са 2+ в цитозоль.
Таким образом, представленные данные о вторичных мессенджерах свидетельствуют о том, что каждой из этих систем посредников гормонального эффекта соответствует определенный класс протеинкиназ, хотя нельзя исключить возможности существования тесной связи между этими системами. Активность протеинкиназ типа А регулируется цАМФ, протеинкиназы G – цГМФ; Са 2+ -кальмодулинзависимые протеинкиназы находятся под контролем внутриклеточной [Са 2+ ], а протеинкиназа типа С регулируется диацилглицеролом в синергизме со свободным Са 2+ и кислыми фосфолипидами. Повышение уровня какого-либо вторичного мес-сенджера приводит к активации соответствующего класса протеинкиназ и последующему фосфорилированию их белковых субстратов. В результате меняется не только активность, но и регуляторные и каталитические свойства многих ферментных систем клетки: ионных каналов, внутриклеточных структурных элементов и генетического аппарата.
2)Реализация эффекта после проникновения гормона внутрь клетки
Во этом случае рецепторы для гормона находятся в цитоплазме клетки. Гормоны этого механизма действия в силу своей липофильности легко проникают через мембрану внутрь клетки-мишени и связываются в ее цитоплазме специфическими белками-рецепторами. Гормон-рецепторный комплекс входит в клеточное ядро. В ядре комплекс распадается, и гормон взаимодействует с определенными участками ядерной ДНК, следствием чего является образование особой матричной РНК. Матричная РНК выходит из ядра и способствует синтезу на рибосомах белка или белка-фермента. Так действуют стероидные гормоны и производные тирозина — гормоны щитовидной железы. Для их действия характерна глубокая и длительная перестройка клеточного метаболизма.
Известно, что эффект стероидных гормонов реализуется через генетический аппарат путем изменения экспрессии генов. Гормон после доставки с белками крови в клетку проникает (путем диффузии) через плазматическую мембрану и далее через ядерную мембрану и связывается с внутриядерным рецептором–белком. Комплекс стероид–белок затем связывается с регуляторной областью ДНК, с так называемыми гормончувствительными элементами, способствуя транскрипции соответствующих структурных генов, индукции синтеза белка de novo и изменению метаболизма клетки в ответ на гормональный сигнал.
Следует подчеркнуть, что главной и отличительной особенностью молекулярных механизмов действия двух основных классов гормонов является то, что действие пептидных гормонов реализуется в основном путем посттрансляционных (постсинтетических) модификаций белков в клетках, в то время как стероидные гормоны (а также тиреоидные гормоны, ретиноиды, витамин D3-гормоны) выступают в качестве регуляторов экспрессии генов.
Инактивация гормонов происходит в эффекторных органах, в основном в печени, где гормоны претерпевают различные химические изменения путем связывания с глюкуроновой или серной кислотой либо в результате воздействия ферментов. Частично гормоны выделяются с мочой в неизмененном виде. Действие некоторых гормонов может блокироваться благодаря секреции гормонов, обладающих антагонистическим эффектом.
Источник статьи: http://allhormon.narod.ru/mechanism.htm