Основные гормоны долей гипофиза
Гипофиз – это округлый придаток головного мозга, регулирующий работу эндокринной системы. Его анатомические характеристики:
- Локализация. Железа внутренней секреции расположена в ямке на клиновидной кости. Гипофиз относится к нижней части мозга. Сверху прикрыт твердой мозговой оболочкой, в которой находится воронка для связи с гипоталамусом. По бокам имеются синусы (полости) с венозной кровью. Спереди и позади органа есть венозные ветви, окружающие его кольцом и отграничивающие от внутренних сонных артерий. На передней доле можно обнаружить перекрест зрительных нервов.
- Развитие.Закладка будущей железы происходит к концу первого месяца внутриутробного развития. Две доли имеют совершенно разные клеточные источники, поэтому в дальнейшем их функциональные свойства также отличаются. Передняя доля вначале имеет вид отростка пальцевидной формы. Последняя образуется из клеток промежуточного мозга и формируется позже, чем передняя.
- Особенности строения. Основная доля гипофиза – передняя. Она составляет приблизительно 75% от всего объема и называется аденогипофиз. В свою очередь эта доля делится на переднюю, среднюю и верхнюю.
- Гистологическая (тканевая) структура. Передняя часть гипофиза имеет волокна из железистых клеток. При исследовании ее строения обнаруживают два вида клеток. Они по-разному окрашиваются красителями. Второй тип окрашивается основаниями (щелочами) и назван базофилами (базис-основание). Их всего 10% от всей массы. По образуемому гормону базофилы делятся на: тиреотрофы (тиреотропин); гонадотрофы (лютропин, фолитропин); кортикотрофы (кортикотропин).
Для желез эндокринной системы гипофиз является регулятором и контролером их работы. Механизм взаимодействия построен по механизму обратной связи: если железа работает слабо, то гипофиз направляет к ней соответствующий «тропный» гормон для стимуляции. При избыточном синтезе или приеме медикаментов-аналогов гипофизарные клетки останавливают выброс в кровь активирующих веществ.
Функции гормонов передней доли:
- Тиреотропный способствует выработке тироксина и трийодтиронина в щитовидной железе, стимулирует ее рост, питание кровью, образование новых клеток. Синтез ТТГ обратно пропорционален концентрации тиреоидных гормонов.
- Лютропин обеспечивает образование прогестерона и эстрогена у женщин, а у мужчин отвечает за секрецию тестостерона. Под его влиянием происходит овуляция и выход сперматозоидов.
- Фолликулостимулирующий гормон активирует рост фолликулов и формирование сперматозоидов,
то есть создает условия для последующего оплодотворения. ЛГ и ФСГ называются гонадотропными, их уровень имеет циклические колебания в женском организме, а у мужчин он определяется постоянной секрецией тестостерона. У детей выделение ЛГ и ФСГ подавлено под действием мелатонина, синтезируемого шишковидной железой.
- Кортикотропин обеспечивает образование кортизола и кортикостерона в пучковой зоне, стимулирует выработку мужских половых гормонов в сетчатом слое, незначительно увеличивает продукцию альдостерона в клубочках, принимает участие в ответной реакции на стрессовые факторы, помогает приспособиться организму к изменениям внешней среды.
- Гормон роста оказывает прямое действие на костную, хрящевую, жировую и мышечную ткань. Синтез возрастает в период сна, голодания, при поступлении аминокислот с пищей, стрессовых ситуациях. Тормозит образование соматотропного гормона прием высокоуглеводной и жирной пищи. Дефицит гормона роста у детей приводит к половому недоразвитию и карликовому росту, а у взрослых тормозится обмен веществ, нарастает объем жировой ткани, а мышечной снижается.
- Пролактин обеспечивает кормление ребенка молоком после родов. Образование пролактина возрастает при повышении уровня эстрогенов, серотонина, мелатонина, в период сосания груди младенцем, при тревоге, боли, стрессе и депрессии, во время сна. Снижение синтеза вызывают гонадотропины и прогестерон.

Функции задней доли:
- Вазопрессинобладает таким влиянием на организм: задерживает воду; увеличивает сократимость мышц сосудов, повышает их тонус; раздражает центр жажды; улучшает обучаемость; регулирует теплообмен; поддерживает биоритмы; влияет на эмоциональный фон.
- Окситоцинповышается к концу беременности, облегчает течение родов, усиливает сокращение матки, протоков молочных желез при кормлении ребенка. Обладает способностью: усиливать выведение жидкости и натрия; регулировать жажду; повышать память; стимулировать выделение гормонов передней доли; снижать АД.
Роль средней доли: меланотропин преимущественно вырабатывается у плода, а затем его количества у взрослых минимальны. Основные функции МСГ: образование пигмента, который определяет окраску глаз, кожи и волос; участие в иммунных реакциях; обеспечение защиты кожи от повреждения ультрафиолетом.
Читайте подробнее в нашей статье о гормонах долей гипофиза.
Основные характеристики гипофиза
Гипофиз – это округлый придаток головного мозга, регулирующий работу эндокринной системы. Для понимания особенностей его функционирования важно знать основные анатомические характеристики.
Локализация
Эта железа внутренней секреции расположена в ямке на клиновидной кости. Гипофиз относится к нижней части мозга – его основанию. Сверху прикрыт твердой мозговой оболочкой, в которой находится воронка для связи с гипоталамусом. По бокам имеются синусы (полости) с венозной кровью.
Спереди и позади органа есть венозные ветви, окружающие его кольцом и отграничивающие от внутренних сонных артерий. На передней доле можно обнаружить перекрест зрительных нервов. Гипофиз похож на небольшую фасоль, его масса менее 1 г.
Развитие
Закладка будущей железы происходит к концу первого месяца внутриутробного развития. Две доли имеют совершенно разные клеточные источники, поэтому в дальнейшем их функциональные свойства также отличаются. Передняя доля происходит из задней стенки ротовой бухты. Она вначале имеет вид отростка пальцевидной формы.
По мере роста он направляется к основанию мозга и в области третьего желудочка соединяется с задней частью. Последняя образуется из клеток промежуточного мозга и формируется позже, чем передняя.

А здесь подробнее об адреногенитальном синдроме.
Особенности строения
Основная доля гипофиза – передняя. Она составляет приблизительно 75% от всего объема и называется аденогипофиз. В свою очередь эта доля делится на:
- переднюю (находится в ямке турецкого седла);
- среднюю (примыкает к задней доле гипофиза);
- верхнюю (ближе к гипоталамусу).
В задней гипофизарной доле (нейрогипофиз) есть нервная часть, вороночная и срединная. Две доли имеют разные темпы развития, строение, функции, а также индивидуальное питание кровью и собственные связи с гипоталамусом. Вместе с ним они объединена в гипофизарно-гипоталамический комплекс, который контролирует работу всей эндокринной системы организма.
Гистологическая (тканевая) структура
Передняя часть гипофиза имеет волокна из железистых клеток. При исследовании ее строения обнаруживают два вида клеток. Они по-разному окрашиваются красителями. Если хорошо воспринимают кислые, то называются ацидофильными (ацидум – кислота).
Среди них есть соматотрофы (для синтеза соматотропина) и лактотрофы (образуют пролактин). Второй тип окрашивается основаниями (щелочами) и назван базофилами (базис-основание). Их всего 10% от всей массы, но они больше ацидофилов. По образуемому гормону базофилы делятся на:
- тиреотрофы (тиреотропин);
- гонадотрофы (лютропин, фолитропин);
- кортикотрофы (кортикотропин).
Интересно, что ацидофильные и базофильные клетки при болезнях гипофиза могут замещать своих «коллег», но только тех, которые имеют такое же окрашивание. Например лактотрофы образуют соматотропин. Есть мнение, что в зависимости от потребностей организма часть клеток приобретает совершенно новые свойства.
Промежуточная часть гипофиза – это тонкая прослойка больших базофильных клеток, синтезирующих интермедин (меланотропин). Задняя часть органа представляет собой своеобразный накопитель и выделитель гормонов. Их образует гипоталамус в супраоптическом и паравентрикулярном скоплении клеток (ядрах). Эти гормоны переходят в гипофиз по особым отросткам нейронов, хранятся в задней доле, а команды на их выброс отдает сам гипоталамус.
Физиологическое значение гипофиза
Для желез эндокринной системы гипофиз является регулятором и контролером их работы. Механизм взаимодействия построен по механизму обратной связи – если железа работает слабо, то гипофиз направляет к ней соответствующий «тропный» гормон для стимуляции. При избыточном синтезе или приеме медикаментов-аналогов гипофизарные клетки останавливают выброс в кровь активирующих веществ.
Щитовидная железа координируется тиреотропным гормоном (тиреотропином, ТТГ), а надпочечники – адренокортикотропным (АКТГ, кортикотропин). Гонадотропины (фолликулостимулирующий ФСГ и лютеинизирующий ЛГ) отвечают за половую систему. В аденогипофизе есть и гормоны, которые напрямую действуют на ткани, им не нужны при этом другие гормональные соединения. Это гормон роста (соматотропин) и пролактин, обеспечивающий лактацию.
Образно гипофиз можно назвать командиром среднего звена, так как над ним есть еще и гипоталамус. Он выдает команды гипофизу при помощи своих гормонов – либеринов (освободителей) и статинов (тормозящих секрецию).
Хотя и гипоталамус в этой цепи не главный (подчиняется высшим мозговым центрам), но реакции гипоталамус-гипофиз-железа имеют определенную автономность, самостоятельность, что объясняет продолжение жизнедеятельности пациентов в состоянии комы.
Функции долей гипофиза
Гормональная активность гипофизарных клеток является основной биологической задачей этого органа.
Гормоны передней доли
Тиреотропный гормон способствует выработке тироксина и трийодтиронина в щитовидной железе, стимулирует ее рост, питание кровью, образование новых клеток. Синтез ТТГ обратно пропорционален концентрации тиреоидных гормонов. Тормозящим влиянием на его продукцию обладают вещества, выделяющиеся при воспалении, стрессе. К повышению концентрации приводит гипотиреоз, удаление части или всей щитовидной железы, лучевая терапия радиоактивным йодом.

При избыточном уровне ТТГ в организме возникает тиреотоксикоз (тахикардия, ускорение обмена, повышение температуры, высокая возбудимость нервной системы, смещение вперед глазных яблок). Низкое содержание приводит к постепенному или резкому падению функции щитовидной железы (сонливость, сильная слабость, замедление сердечного ритма, прибавка веса).
Лютропин обеспечивает образование прогестерона и эстрогена у женщин, а у мужчин отвечает за секрецию тестостерона. Под его влиянием происходит овуляция и выход сперматозоидов. Поэтому нехватка лютеинизирующего гормона приводит к нарушению менструального цикла у женщин и к бесплодию у обоих полов.
Фолликулостимулирующий гормон активирует рост фолликулов и формирование сперматозоидов, то есть создает условия для последующего оплодотворения. ЛГ и ФСГ называются гонадотропными, их уровень имеет циклические колебания в женском организме, а у мужчин он определяется постоянной секрецией тестостерона.
У детей выделение ЛГ и ФСГ подавлено под действием мелатонина, синтезируемого шишковидной железой. При низком уровне нарушается половое созревание, высоким ростом, так как нет своевременного закрытия зон окостенения. Высокие концентрации вызывают раннее появление вторичных половых признаков и низкий рост тела.
Кортикотропин имеет следующие надпочечниковые эффекты:
- обеспечивает образование кортизола и кортикостерона в пучковой зоне;
- стимулирует выработку мужских половых гормонов в сетчатом слое;
- незначительно увеличивает продукцию альдостерона в клубочках;
- принимает участие в ответной реакции на стрессовые факторы;
- помогает приспособиться организму к изменениям внешней среды.
К вненадпочечниковым биологическим реакциям относятся:
- повышение выделения инсулина и гормона роста;
- стимуляция отложения пигмента в коже (меланина);
- снижение уровня глюкозы, расщепление жиров.
Смотрите на видео о гипофизе и гипоталамусе:
Уровень АКТГ возрастает при боли, холоде, положительных и отрицательны эмоциях, физическом перенапряжении, снижении концентрации кортизола в крови, беременности, аденоме гипофиза. Низкие показатели обычно вызваны повышением синтеза кортизола, опухолевым процессом или применением гормональной терапии (Гидрокортизон, Преднизолон и их аналоги).
Гормон роста оказывает прямое действие на костную, хрящевую, жировую и мышечную ткань. Его основные функции:
- облегчает усвоение глюкозы и ее превращения в энергию;
- ускоряет образование гликогена (запаса глюкозы) и его расщепление;
- стимулирует образование новых молекул глюкозы;
- увеличивает выброс глюкагона (антагониста инсулина) и инсулина, но снижает чувствительность к нему тканей;
- активизирует расщепление жира до жирных кислот и их утилизацию для пополнения энергии;
- способствует образованию белков из аминокислот, продукцию молока при лактации;
- повышает скорость обменных процессов, роста костей, наращивает массу мышц;
- усиливает действие адреналина на расщепление жира;
- увеличивает активность тканевых факторов роста.
Синтез возрастает в период сна, голодания, при поступлении аминокислот с пищей, стрессовых ситуациях. Тормозит образование соматотропного гормона прием высокоуглеводной и жирной пищи. Дефицит гормона роста у детей приводит к половому недоразвитию и карликовому росту, а у взрослых тормозится обмен веществ, нарастает объем жировой ткани, а мышечной снижается.
Пролактин обеспечивает кормление ребенка молоком после родов. К его важным свойствам относятся:
- подавление выделения ЛГ и ФСГ, прогестерона;
- участие в развитии желтого тела;
- торможение овуляции и возможности зачатия в период лактации;
- появление у матери родительских инстинктов, немного обезболивает при родах;
- помогает образованию у плода легочного сурфактанта (нужен для раскрытия легких);
- у ребенка обеспечивает развитие вилочковой железы, функционирование иммунной системы;
- стимулирует продукцию вазопрессина и альдостерона;
- регулирует водно-солевой обмен.
Образована пролактина возрастает при повышении уровня эстрогенов, серотонина, мелатонина, в период сосания груди младенцем, при тревоге, боли, стрессе и депрессии, во время сна. Снижение синтеза вызывают гонадотропины и прогестерон.
Смотрите на видео о гормонах гипофиза:
Функции задней доли
Вазопрессин обладает таким влиянием на организм:
- задерживает воду;
- увеличивает сократимость мышц сосудов, повышает их тонус;
- раздражает центр жажды;
- улучшает обучаемость;
- регулирует теплообмен;
- поддерживает биоритмы;
- влияет на эмоциональный фон.
Секреция антидиуретического гормона повышается при стрессе, физической активности, снижается при высоком давлении, приеме алкоголя. Недостаток сопровождается обильным выделением мочи низкой плотности (несахарный диабет), а избыток – отечностью, задержкой воды и водным отравлением.
Окситоцин повышается к концу беременности, облегчает течение родов, усиливает сокращение матки, протоков молочных желез при кормлении ребенка. Помимо этих основных эффектов, обладает способностью:
- усиливать выведение жидкости и натрия;
- регулировать жажду;
- повышать память;
- стимулировать выделение гормонов передней доли;
- снижать артериальное давление.
Синтез этого гормона увеличивают эстрогены, растяжение шейки матки в родах и стимуляция сосков при кормлении младенца.
Роль средней доли
Меланотропин преимущественно вырабатывается у плода, а затем его количества у взрослых минимальны. Основные функции МСГ:
- образование пигмента, который определяет окраску глаз, кожи и волос;
- участие в иммунных реакциях;
- обеспечение защиты кожи от повреждения ультрафиолетом.
Потемнение кожи бывает при беременности, болезнях надпочечников, так как АКТГ и липотропин могут усилить синтез МСГ.

А здесь подробнее о нарушении работы гипофиза.
Гипофиз относится к эндокринным железам. Его роль состоит в образовании гормонов с прямым эффектом – меланотропин, соматотропин и пролактин, а также тропных. Последние свое действие реализуют через щитовидную железу, надпочечные и половые железы.
В задней доле накапливаются и выделяются вазопрессин и окситоцин. Каждый из гормонов имеет специфические функции и общее влияние на обменные процессы. Регулируется гормональная активность гипофиза гипоталамусом и по механизму обратной связи гормонами желез-мишеней.
Преимущественно недостаточность гипофиза возникает у пожилых, но бывает врожденная или приобретенная у детей, послеродовая. Также выделяют тотальную, парциальную, первичную и вторичную. Диагностика синдрома гипопитуитарима включает анализ на гормоны, МРТ, КТ, рентген и прочие. Лечение — восстановление функции гормонами.
Провоцировать нарушение работы гипофиза могут многие факторы. Признаки не всегда явные, а симптомы больше схожи на проблемы со стороны эндокринологии у мужчин и женщин. Лечение комплексное. Какие нарушения связаны с работой гипофиза?
Встречается гигантизм, причины которого — нарушение выработки гормона роста, у взрослых и детей. Симптомы — жажда, умственное отставание, высокий рост, нарушения формирования вторичных половых признаков. Лечение зависит от степени прогрессирования заболевания.
Проявляется адреногенитальный синдром еще до рождения на УЗИ. Имеет три формы — сольтеряющу, вирильную и неклассическую. Симптомы у мальчиков — увеличение мошонки, пениса. У девочек — большой клитор. Симптомы у новорожденных корректируют операцией, лечение на протяжении всей жизни. Диагностика и скрининг проводятся во время беременности и после родов.
Если точно подтвержден гиперпаратиреоз, питание больного требует соблюдения определенных правил. Например, диета у женщин предполагает ограничение поступления кальция.
Источник статьи: http://endokrinolog.online/gormony-dolej-gipofiza/
Медицинская учебная литература
Учебная медицинская литература, онлайн-библиотека для учащихся в ВУЗах и для медицинских работников
Патофизиология гипофиза
Общая характеристика гормонов гипофиза.
Гипофиз (мозговой придаток, питуитарная железа) — это эндокринная железа, расположенная у основания головного мозга в турецком седле основной кости черепа и тесно связанная анатомически и функционально с гипоталамической областью мозга гипофизарной (инфундибулярной) ножкой — выростом воронки III желудочка.
Гипофиз выделяет несколько гормонов, регулирующих активность других эндокринных желез (тропные гормоны) и несколько гормонов, обладающих непосредственным периферическим действием. Сам гипофиз в свою очередь находится под контролем нейросекреторных ядер гипоталамуса. Некоторые гипофизарные гормоны самостоятельно образуются в нейросекреторных клетках гипоталамуса и далее перемещаются в гипофиз.
Гипофиз состоит из трех основных частей — передней, средней и задней долей. Передняя и средняя доли имеют эпителиальную структуру и объединены названием «аденогипофиз». Задняя доля гипофиза, или нейрогипофиз, является выростом мозга и состоит из модифицированных клеток нейроглии (питуицитов).
Аденогипофиз (передняя доля гипофиза) вырабатывает восемь гормонов ( Приведены названия гормонов, рекомендованные Международной комиссией по биохимической номенклатуре, в скобках — традиционные названия и их сокращения.) :
- фоллитропин (фолликулостимулирующий гормон, ФСГ);
- лютеотропин (лютеинизирующий гормон, ЛГ; гормон, стимулирующий интерстициальные клетки тестикул — ГСИК):
- пролактин (лютеомаммотропный гормон, ПРЛ, ЛТГ);
- кортикотропин (адренокортикотропный гормон, АКТГ);
- тиреотропин (тиреотропный гормон, ТТГ);
- соматотропин (соматотропный гормон, СТГ);
- липотропин (липотропный гормон, ЛТГ);
- меланотропин (меланоцитостимулирующий гормон, МСГ).
Первые семь гормонов вырабатываются в передней доле гипофиза, восьмой — в средней доле.
Фоллитропин (ФСГ). В женском организме ФСГ стимулирует рост и созревание овариальных фолликулов, в мужском организме — рост и пролиферацию семяобразуюших канальцев яичка и процесс сперматогенеза.
Лютотропин (ЛГ,ГСП К). Этот гормон способствует завершению созревания яйцеклеток, процессу овуляции и образованию желтого тела. У мужских особей способствует дифференциации интерстициальной ткани яичка в активные клетки Лейдига и стимулирует продукцию половых гормонов.
Пролактин (ПРЛ, ЛТГ). Данный гормон относится, как ФСГ и ЛГ, к группе гонадотропных гормонов, поддерживая в некоторой степени гормональную деятельность желтых тел и тем самым выполняя функцию тропного гормона. Однако ПРЛ обладает и прямым периферическим действием непосредственно на молочные железы, стимулируя образование молока. У мужских особей ПРЛ, вероятно, является дополнительным фактором роста предстательной железы и других придаточных половых органов.
Kopmuкompoпин (адренокортикотропный гормон— АКТГ) . Гормон стимулирует пролиферацию клеток коры надпочечников, особенно в пучковой и сетчатой зонах, и является главным стимулятором биосинтеза глюкокортикоидов, а также андрогенных кортикостероидов. В известной степени АКТГ участвует в регуляции синтеза и секреции минералокортикоида альдостерона (влияя на трофику коры над почечников).
Помимо своей основной функции — регуляции гормональной активности коры надпочечников, АКТГ способствует мобилизации жиров из жировых депо и их окислению, усиливает кетогенез. способствует накоплению гликогена в мышцах и транспорту в них аминокислот. В условиях стресса АКТГ не только стимулирует образование кортикостероидов, но и их разрушение в печени. Адренокортикотропный гормон действует также на меланофоры, вызывая усиление пигментации кожи и ее потемнение.
Тиреотропин (ТТГ) . Специфическое действие ТТГ состоит в стимуляции гормональной активности щитовидной железы. Он оказывает влияние на все фазы биосинтеза тиреоидных гормонов — тироксина и трийодтиронина: стимулирует транспорт йодидов в клетки щитовидной железы, окисление их в молекулярный йод, соединение его с тирозином, синтез гормонов, их освобождение из связи с тиреоглобулином и секрецию. Возможны и некоторые механизмы стимуляции тиреоидных эффектов тиреотропином. Тиреотропин способствует пролиферации фолликулярных клеток щитовидной железы.
Соматотропин (СТГ гормон роста) . Соматотропный гормон является не регулятором другой эндокринной железы, а гормоном с прямым воздействием на клетки-мишени периферических тканей. Этот гормон обладает выраженным белковоанаболическим и ростовым воздействием, в значительной мере определяя темп развития организма и его окончательные размеры. Соматотропин стимулирует транспорт аминокислот из крови в клетки и их утилизацию в протеосинтезе, рост и развитие скелета, активизируя процессы хондро-, остеогенеза и др. Механизмы ростовых эффектов СТГ реализуются на рибосомальном уровне, однако не непосредственно, а с участием группы пептидов, образующихся под влиянием СТГ в периферических тканях, — так называемых соматомединов.
Наряду с «медленными» ростовыми эффектами СТГ обладает свойством вызывать «быстрые» метаболические эффекты, опосредованные аденилатциклазной системой. К таким эффектам относятся, в частности, усиление липолиза, кетогенеза и гликогенолиза, изменение проницаемости клеточных мембран, торможение утилизации глюкозы в некоторых тканях, общее гипергликемическое действие и др. Некоторые из «быстрых» метаболических эффектов имеют противоположную инсулину направленность и поэтому СТГ иногда называли «диабетогенным» гормоном. Из всех гипофизарных гормонов соматотропин обладает наибольшей видовой специфичностью.
Липотропин (ЛПГ). В настоящее время наиболее изучен β-липотропин. полипептид, который наряду с другими гипофизарными гормонами оказывает жиромобилизующее действие и стимулирует использование жиров в энергетическом обмене. Помимо β-липотропина, в аденогипофизе вырабатываются и другие липотропные факторы.
Меланотропин (АСГ). Гормон образуется в промежуточной (у человека — рудиментарной) доле гипофиза. Вызывает дисперсию пигментных гранул — меланосом в меланоцитах, что проявляется потемнением кожи. Пигментный эффект МСГ связан также с его стимулирующим влиянием на ферментные системы меланоцитов, участвующие в синтезе меланина. Помимо влияния на пигментацию, МСГ способен оказывать некоторое влияние на жировой и белковый обмены.
формирование эмбриона, функцию нервной системы.
Секреторную активность аденогипофиза контролирует несколько гипоталамических факторов —- пептидных гормонов, поступающих по портальным сосудам из нейросекреторной ткани срединного возвышения гипоталамуса непосредственно к железистым клеткам гипофиза. Здесь они стимулируют или тормозят их секреторную активность. Стимулирующие факторы получили название «рилизинг-факторы». или «либерины» (более современный термин), а тормозящие — «статпны» (табл. 15.1).
Некоторые либерины в настоящее время точно не идентифицированы и само их существование сомнительно (пролактолиберин, активизирующий фактор ЛПГ, меланолиберин). В отношении некоторых статинов также пока достоверных данных не имеется. Помимо основной системы либеринов и статинов, в регуляции аденогипофиза могут принимать участие другие дополнительные факторы и механиз мы: внегипоталамические нейропептиды, ангиотензин-П, симпатическая нервная система и др.
В целом система гипоталамо-гипо-физарной нейроэндокринной регуляции (включая управляемые периферические железы и ткани-мишени) построена на основе обратных связей и схематически представлена на рис. 15.1.
Типовые формы нарушений функции аденогипофиза.
Существуют следующие важнейшие формы нарушений функций аденогипофиза:
- гипофункциональные состояния (гипопитуитаризм);
- гиперфункциональные состояния (гиперпитуитаризм);
- первично гипофизарные;
- вторичные (гипоталамические);
- парциальные;
тотальные (пангипопитуитаризм); ранние до полового созревания; поздние (у взрослых) Гипопитуитаризм . Причинами гипопитуитаризма могут служить хромофобные (гормонально неактивные) аденомы передней доли гипофиза, состояния после хирургического лечения гипофизарных аденом и послеродовые некрозы аденогипофиза. Тотальный гипопитуитаризм может быть также вызван механической травмой, тромбозом сосудов, кровоизлиянием, инфекциями и интоксикациями, длительным голоданием. Иногда тяжелая гипофизарная недостаточность возникает вследствие патологических процессов в гипоталамусе.
Рис. 15.1. Упрошенная схема гипоталамо-гипофизарной нейроэндокринной регуляции: 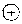

Проявления тотального гипопитуитаризма (гипофизарной кахексии, болезни Симмондса) характеризуются картиной резкого истощения, преждевременного старения, тяжелыми обменно-трофическими расстройствами, нарушениями функции периферических гипофиззависимых эндокринных желез. Похудание происходит за счет исчезновения подкожного жирового слоя и других жировых отложений, атрофии мышц и внутренних органов. Оно может развиваться постепенно (с потерей массы тела примерно 3 — 6 кг в месяц), но встречаются и так называемые галопирующие формы, когда больные теряют до 20—25 кг в течение одного месяца. Часто развиваются диспепсические расстройства: рвота, поносы, боли в животе, атония кишечника, отвращение к пище. Возникает выраженная артериальная гипотензия вплоть до коллапса.
Истощение в терминальной стадии заболевания может быть настолько резко выражено, что больные напоминают скелет, обтянутый кожей, полностью безразличны к окружающему и к собственной участи, неподвижно лежат в состоянии полной прострации. Своеобразной формой пангипопитуитаризма является болезнь, или синдром, Шихена, возникающая в качестве послеродового осложнения. В основе заболевания обычно лежит значительная и своевременно не возмещенная кровопотеря во время родов, сопровождающаяся спазмом сосудов передней доли гипофиза. При длительном спазме сосудов могут развиваться ишемический некроз гипофиза и типичная картина гипофизарной кахексии, но в большинстве случаев расстройства не столь резко выражены.
Атрофия гипофиза, сопровождающаяся кахексией, вызывается длительным голоданием (особенно белковым).
Вариантом подобного патогенеза тотального гипопитуитаризма является психогенная анорексия, развивающаяся вначале на почве каких-либо психотравмирующих ситуаций, а затем переходящая в стойкое отвращение к еде. Возможно, во всех подобных случаях существует предрасположенность как со стороны нервно-психической сферы, так и гипоталамо-гипофизарной системы.
Парциальный гипопитуитаризм возникает в результате недостаточности какого-либо одного тропного гормона (хотя строго моногормональные формы патологии почти не встречаются).
Приведем наиболее характерные и частые заболевания, в основе которых лежит частичная аденогипофизарная недостаточность.
Гипофизарная карликовость, или гипофизарный нанизм (от греч. nanos — карлик), — заболевание, характеризующееся резкой задержкой роста, а также половым недоразвитием в результате недостаточного образования соматотропина и гонадотропинов, возникающего уже на стадии внутриутробного развития. Поэтому масса новорожденных обычно значительно меньше нижней границы нормы, в дальнейшем отставание в росте и массе прогрессирует, и физическое развитие рано прекращается. Рост ниже 130 см принято считать карликовым, встречаются больные ниже 100 см.
Гипофизарная карликовость обычно не сопровождается грубыми нарушениями телосложения, однако у взрослых карликов сохраняются пропорции тела, свойственные младшему детскому возрасту с преобладанием длины туловища над длиной конечностей. Характерно морщинистое лицо, рано приобретающее старческий вид, часто бывает трудно определить по лицу пол карлика и его возраст.
Как правило, наблюдается недоразвитие половой системы (половых желез, половых органов и вторичных половых признаков), приводящее к бесплодию. В психическом развитии существенных нарушений обычно не происходит, хотя часто отмечаются некоторая инфантильность в поведении, снижение памяти и умственной работоспособности.
Каких-либо специфических этиологических факторов гипофизарного нанизма не выявлено, и в качестве причин данного заболевания могут, по-видимому, выступать многие патогенные воздействия и патологические процессы, в том числе у матери во время беременности.
Гипофизарный гипогонадизм, или недостаточность гонадотропинов проявляются на ранних стадиях развития у мужских особей в виде евнухоидизма, у женских — гипофизарного инфантилизма.
Для мальчиков и юношей, страдающих евнухоидизмом, характерны высокий рост, длинные тонкие кости конечностей, узкие плечи и относительно широкий таз, слабое развитие скелетной мускулатуры, тонкая бледная кожа. Специфические признаки гипогонадизма проявляются в недоразвитии половых желез, наружных половых органов и вторичных половых признаков, характерны скудный рост волос на лице, высокий тембр голоса. Нередко отмечаются поведенческие особенности, не свойственные мужским особям. Признаки евнухоидизма сохраняются и у взрослых больных, обычно не способных к деторождению.
Для гипофизарного женского инфантилизма также характерно слабое, субтильное телосложение без выраженных признаков, свойственных женскому организму. Недоразвиты молочные железы, поздно появляются менструации; как правило, имеются различные нарушения менструального цикла. Характерны легкая психическая ранимость, неустойчивость настроения. Выраженные формы гипофизарного инфантилизма сопровождаются неспособностью к зачатию либо различными нарушениями беременности.
Каких-либо специфических этиологических факторов гипофизарного гипогонадизма не установлено, и в качестве таковых могут выступать различные патогенные агенты, реализующие свое действие на уровне гипоталамуса и гипофиза.
Нейроэндокринное ожирение может проявляться многочисленными вариантами, отличающимися по своим патогенетическим механизмам. В основе некоторых из них лежит недостаточный биосинтез в аденогипофизе жиромобилизующего полипептида липотропина в результате поражения самого гипофиза или гипоталамических центров с вторичным вовлечением гипофиза. Для гипофизарного ожирения характерно избыточное отложение жира на животе, спине и в проксимальных отделах конечностей при относительной «худобе» дистальных отделов — предплечий и голеней.
Адипозогенитальная дистрофия (болезнь Фрелиха) — заболевание, проявляющееся двумя основными синдромами — ожирением и гипогонадизмом. Болезнь развивается при врожденных изменениях гипототаламуса и гипофиза или поражениях межуточного мозга различными патогенными факторами, в том числе инфекциями, в эмбриональном и пост-эмбриональном периодах. Встречаются случаи этого заболевания без видимых изменений гипоталамуса и гипофиза. Адипозогенитальная дистрофия
проявляется диффузным ожирением с преимущественным отложением жира в области груди, живота, таза, бедер и лица. Развитие первичных и вторичных половых признаков резко задержано; при возникновении заболевания в более поздние периоды жизни отмечается обратное развитие гениталий.
Дефицит кортикотропина (АКТП) и тиреотропина (ТТЛ) приводит соответственно к вторичным или третичным (гипофизарным или гипоталамическим формам гипокортицизма и гипотиреоза (данные формы патологии рассматриваются в подразделах, посвященных патофизиологии надпочечников и щитовидной железы). Недостаточность продукции меланотропина клинического значения не имеет.
Гиперпитуитарызм.
Гиперпродукция аденогипофизарных гормонов, как правило, носит парциальный характер и выражается в следующих наиболее частых формах.
Гипофизарный гигантизм развивается в результате чрезмерной секреции соматотропина, на ранних стадиях развития организма приводит к гипофизарному гигантизму. Главное проявление заболевания — усиленный рост, выходящий за пределы норм верхней границы для данного возраста, пола, расы. Известны случаи, когда больные достигали к 10-летнему возрасту роста 190 см, к 18-летнему — 250 см. Встречаются гипофизарные гиганты ростом свыше 260 см. Грубых диспропорций телосложения обычно не наблюдается, но чрезмерной относительной длиной отличаются предплечья и голени, голова относительно мала, с удлиненным лицом. Мышечная система в начале заболевания в большинстве случаев развита хорошо, но в дальнейшем возникают мышечная слабость, быстрая утомляемость, иногда мышечная гипотрофия.
В некоторых случаях размеры внутренних органов непропорционально велики, в других случаях — отстают от роста тела и возникает их относительная функциональная недостаточность (в частности, сердечно-сосудистой системы). В большинстве случаев наблюдается гипергликемия, может развиться сахарный диабет. Со стороны половой сферы обычно отмечаются явления более или менее выраженного гипогенитализма. Часто отмечаются различные не резко выраженные отклонения в психической сфере. Гигантизм может сопровождаться патологией других периферических эндокринных желез.
Причиной гигантизма являются опухолевые процессы (эозинофильная аденома) и гиперплазия эозинофильных клеток передней доли гипофиза, связанная с чрезмерными стимулирующими влияниями гипоталамуса. Нередко прослеживается связь с перенесенными в детстве инфекционными заболеваниями. Определенное значение имеет наследственная предрасположенность. Нередко этиология гигантизма остается неизвестной.
Акромегалия развивается в результате чрезмерной продукции соматотропина у взрослых. Заболевание характеризуется возобновлением периостального роста костей, вследствие чего происходят их утолщение и деформация. Анаболическое действие СТГ проявляется также в увеличении массы мягких тканей и внутренних органов. Акромегалия, как правило, сопровождается стойкой гипергликемией и часто — сопутствующим сахарным диабетом, обусловленным недостаточностью инсулярного аппарата; нередко наблюдаются симптомы нарушений функций других эндокринных желез.
Проявления акромегалии характеризуются многочисленными субъективными симптомами: головной болью, слабостью, сонливостью, болями в суставах, снижением остроты зрения, половыми расстройствами. Весьма характерны постепенные изменения внешности: укрупнение черт лица и увеличение дистальных отделов конечностей (кистей и стоп). Утолщаются кости черепа, выступают надбровные и скуловые дуги, челюсти выдаются вперед. Увеличиваются нос, губы, уши, язык; грубеет голос, возникают трофические расстройства кожи и др. Этиология акромегалии такая же, как у гипофизарного гигантизма.
Как и при вызванном эозинофильной аденомой гигантизме, разнообразные проявления акромегалии связаны как с определяющим значением увеличенного образования соматотропина и некоторых других гормонов, так и непосредственно с ростом интракраниальной опухоли.
Раннее половое созревание и другие нарушения в половой сфере обусловлены чрезмерной секрецией аденогипофизом гонадотропинов. Ранние формы патологии проявляются в явно преждевременном половом созревании. Уже в возрасте 6—7 лет развиваются половые железы, у мальчиков начинается сперматогенез; у девочек — созревание фолликулов, овуляция и менструации, появляются свойственные пубертатному периоду вторичные половые признаки.
Гиперпродуклия гонадотропинов у взрослых проявляется в основном у женщин в виде нарушений овариально-менструального цикла и нормального течения беременности.
Синдром персистируюшей лактации вызван избыточной продукцией пролактина. Он проявляется у женщин двумя главными симптомами: непрерывным выделением молока из молочных желез, не связанным с беременностью и кормлением ребенка (галактореей), и отсутствием менструаций (аменореей). У мужчин возникает снижение половой активности и реже — гинекомастия. Наиболее частой причиной заболевания служит пролактин-продуцирующая аденома гипофиза пролактинома.
Гиперсекреция меланотропин а промежуточной долей гипофиза. приводящая к потемнению кожи, самостоятельного патологического значения не имеет и является лишь признаком некоторых других эндокринных нарушений.
Типовые формы нарушения функции нейрогипофиза.
Гормоны нейрогипофиза и их основные эффекты.
Нейрогипофиз секретирует два гормона пептидной природы — антидиуретический гормон (АДГ, вазопрессин) и окситоцин. Оба гормона образуются в нейросекреторных клетках переднего гипоталамуса, поступают по их аксонам в заднюю долю гипофиза, выделяются из терминалей и накапливаются в нейрогипофизе, откуда затем поступают в кровоток.
Антидиуретический гормон усиливает реабсорбцию воды из мочи в дистальных отделах почечных канальцев и является важнейшим регулятором водного баланса организма. Эпителий дистальных почечных канальцев отличается относительно плохой проницаемостью для воды. Поэтому она не может свободно следовать за реабсорбируемым в канальцах натрием, и моча становится относительно гипотоничной. Под влиянием АДГ стенка дистального канальца становится водопроницаемой, вода реабсорбируется по осмотическому градиенту, происходит концентрация мочи и уменьшение ее конечного объема.
Вазопрессорный эффект АДГ выражен лишь при его концентрации, во много раз (примерно 10 3 ) превышающей антидиуретическую. В физиологических условиях вазопрессорное действие обычно не проявляется.
Основным регулирующим секрецию АДГ фактором является осмотическое давление крови, которое воспринимается осморецепторным аппаратом, расположенным в той же области гипоталамуса, где образуется АДГ. При повышении осмотического давления крови секреция АДГ усиливается, стимулируется реабсорбция воды в почечных канальцах и гиперосмия крови устраняется. При понижении осмотического давления крови происходят противоположные процессы. Опосредованно через реабсорбцию натрия в регуляции секреции АДГ участвует альдостерон, в свою очередь связанный с изменениями объема крови и почечного кровотока.
На секрецию АДГ оказывают определенное влияние и другие факторы: высокая температура стимулирует, а низкая тормозит секрецию; усиливают ее стрессорные факторы никотин, морфин и др.
Окситоцин вызывает сокращение мышцы матки в процессе родов и активирует процесс лактации в период кормления. О функциях окситоци-на в мужском организме достоверных сведений нет.
Окситоцин принимает участие в репродуктивных процессах и, соответственно, его секреция стимулируется импульсами, связанными с этими процессами: растяжением родовых путей, раздражением наружных половых органов, а также грудных сосков при кормлении грудью.
Нарушение функций нейрогипофиза.
Недостаточность эффектов антидиуретического гормона клинически проявляется в виде так называемого несахарного диабета.
Существуют две различные по этиологии формы этого заболевания:
- первичная форма, связанная с опухолями гипоталамуса или воздействием на него различных других повреждающих факторов;
- семейная (наследственная) форма, обусловленная ферментным дефектом и неспособностью к синтезу гормона.
Реже встречаются еще две формы заболевания, связанные либо с генетически обусловленным дефектом почечных рецепторов АДГ, либо с приобретенным понижением их чувствительности к гормону.
Главным проявлением несахарного диабета является постоянная полиурия, достигающая в некоторых случаях 20 л/сут и более. Она сопровождается вторичной резко выраженной жаждой. Необходимость в частых мочеиспусканиях (особенно ночью) и постоянном питье вызывают у больных крайне тягостное субъективное состояние. В случае невозмещения потери воды и электролитов легко возникает дегидратация организма.
Гиперсекреция АДГ, называемая гипергидропексическим синдромом (синдромом Пархона), может возникать после повреждений мозга (в частности, после нейрохирургических вмешательств), при повышении внутричерепного давления, возможно, после инфекционных заболеваний, а также в результате эктопической продукции АДГ или подобных ему веществ опухолями неэндокринных органов (особенно легких). Заболевание проявляется олигурией, гипергидратацией и связанной с гемодилюцией гипонатриемией.
Гипосекреция окситоцина может возникать при первичных формах несахарного диабета, однако характерных проявлений она не имеет. Лишь в некоторых случаях появляются затруднения при грудном кормлении.
Гиперсекреция окситоцина у человека не описана.
Стоматологические проявления патологии гипофиза и гипоталамуса.
Гипофизэктомия . Удаление гипофиза вызывает замедление скорости роста костей, угнетение энхондрального окостенения, снижение остеобластической активности и нарушение процесса кальцификации. После удаления гипофиза наблюдаются тяжелые формы патологии пародонта, выражающиеся в расстройстве остеогенеза в альвеолярных костях и межзубных перегородках. дегенерации соединительнотканной связки десны. Подавление функции гипофиза путем облучения у крыс вызывает воспаление и ретракцию десны, изменения в пародонте.
В механизме изменений в минерализованных тканях при снижении функции гипофиза важная роль принадлежит нарушению минерального и белкового обмена. При этом основное значение принадлежит соматотропному гормону, введение которого после гипофизэктомии вызывает нормализацию обменных процессов, стимуляцию эпителизации ран.
Церебрально-гипофизарный нанизм . Изменения различных видов обмена у больных гипофизарной карликовостью находят свое отражение в состоянии зубов, пародонта и челюстных костей.
При гипофизарном нанизме череп сравнительно велик, а лицевой скелет даже в зрелом возрасте напоминает строение костей ребенка.
Задержка роста лицевого скелета особенно выражена в дистальном отделе, при этом у мужчин все линейные параметры основания черепа уменьшены, а у женщин при нормальной длине переднего отдела основания черепа наблюдается уменьшение заднего отдела основания черепа.
При гипофизарном нанизме, связанном с недостатком сомато-, тирео-, гонадотропного и других гормонов, наблюдаются значительные изменения в зубочелюстном аппарате, выражающиеся в нарушении трех основных признаков физиологического прорезывания зубов: срока, парности и последовательности. Эти нарушения выражены больше в постоянном прикусе.
Акромегалия . Кости лицевого черепа при акромегалии растут неравномерно, особенно значительно увеличиваются размеры нижней челюсти, которая становится массивной и выступает вперед. При этом размеры корней зубов в соотношении с телом нижней челюсти оказываются более короткими. Происходит увеличение угла между основанием и ветвью нижней челюсти. Такая картина обычно наблюдается при длительном течении заболевания.
Обнаруживается выраженное расширение хрящевого слоя суставной головки нижней челюсти. Подбородок выдвигается вперед и развивается неправильное соотношение челюстей. С удлинением ветви нижней челюсти связано притупление ее угла. Рост нижней челюсти обусловлен увеличением реактивности хрящевого центра мыщелка нижней челюсти, а также от венечного отростка и угла челюсти. За счет чрезмерного развития альвеолярных отростков увеличивается расстояние между зубами.
Характерно сочетание остеосклероза с нерезко выраженным остеопорозом челюстных костей, а также гиперостоз переднего отдела челюсти. Неравномерное увеличение челюстей сопровождается образованием патологического прикуса, увеличением расстояния между зубами. Образование трем связано с ростом челюстей и сдавлением увеличенного в размере языка, что также приводит к образованию диастемы в переднем отделе челюстей.
Величина зубов при акромегалии не изменяется, но увеличивается отложение цемента в апикальной части корней (гиперцементоз), поэтому они приобретают характерную колбообразную форму. Гиперцементоз рассматривается как защитная реакция, при которой зубы приобретают большую устойчивость к нагрузке.
При акромегалии отмечается развитие множественного кариеса. Иногда заболевание сопровождается гиперплазией слизистых оболочек полости рта (отмечается увеличение размеров языка, он с трудом вмешается в полость рта и затрудняет речь больного, при этом на боковой поверхности языка возможны отпечатки зубов. Вследствие утолщения хрящевой ткани гортани и голосовых связок голос делается низким и грубым).
При акромегалии возможна гипертрофия околоушных слюнных желез.
Гигантизм . Размеры коронок зубов при гигантизме не меняются, но ускоряется формирование корней зубов, отмечается гиперцементоз верхушек корней. Ускоряется развитие зачатков постоянных зубов, более раннее их прорезывание и увеличение размеров зубной дуги.
Отмечается ускоренный рост лицевых костей, особенно нижней челюсти, в которой к 12 -летнему возрасту утолщается кортикальная пластинка и усиливается периостальная оссификация зон прикрепления мышц и сухожилий.
Изменения лицевого скелета, челюстей и зубов при гигантизме сходны с клиническими проявлениями акромегалии, они наиболее выражены при длительном течении заболевания.
Описаны случаи парциального (частичного) гигантизма у детей и взрослых. Они выражаются в том, что у некоторых детей с этим заболеванием увеличиваются размеры губ, щеки, уха только одной стороны лица, соответственно большие размеры коронок молочных зубов. Описаны случаи парциального гигантизма семейного характера. При этом отмечалось выступание скуловой кости, части лобной кости, увеличение размеров одной половины языка.
Гипоталамические (диэнцефальные) синдромы . При преждевременном половом развитии церебрального происхождения могут быть различные изменения и в зубочелюстной системе. Они выражаются в раннем прорезывании постоянных зубов, а также в ускорении их формирования. Отмечается ускорение кальцификации коронок постоянных зубов.
При преждевременном половом развитии «скелетный» возраст значительно превышает хронологический, «зубной» возраст обычно близок к хронологическому, но может опережать его даже на 8—10 лет.
Адипозогенитальная дистрофия. При этом заболевании отмечается запаздывание прорезывания молочных и постоянных зубов, а также формирования их корней, что соответствует обшему замедлению развития организма; наблюдаются и аномалии прикуса. Зубы почти не поражаются кариесом. Часто наблюдается незаращение эпифизарных линий хрящей, что можно связать с недостатком роста в длину костей лицевого скелета.
Болезнь Иценко-Кушинга. В челюстных костях и мягких тканях полости рта у больных обнаруживаются изменения, сходные с теми, которые наблюдаются при этих заболеваниях в скелете, коже, слизистых оболочках. Трофические расстройства слизистой оболочки полости рта у больных характеризуются отечностью, цианозом, трофическими эрозиями, язвами и трещинами. В большинстве случаев наблюдается остеопороз челюстных костей, дистрофические и воспалительные изменения в пародонте. Структура зубных тканей также подвержена изменениям: у значительного числа больных выявлены изменения цвета эмали, хрупкость, стирание зубов, образование дентиклов в пульпе, облитерация зубной полости.
Стоматологическая заболеваемость у таких больных высокая и сопровождается значительной частотой разрушения зубов, дистрофическими и воспалительными изменениями в пародонте и слизистой оболочке полости рта.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник статьи: http://auno.kz/patofiziologiya-tom-2/201-patofiziologiya-gipofiza.html
Гормоны задней доли гипофиза
| Название услуги | Цена |
|---|---|
| Первичная консультация гинеколога | 2 300 руб. |
| УЗИ гинекологическое экспертное | 3 080 руб. |
| Взятие мазка-отпечатка (соскоба)для цитологического исследования | 500 руб. |
| Комплекс «Репродуктивный потенциал» Гормональная оценка фолликулярного запаса яичников (АМГ.ФСГ,ЛГ,эстрадиол) | 1 900 руб. |
| Определение тестикулярного резерва, тест со стимуляцией ФСГ со стоимостью лекарственного препарата | 5 000 руб. |
| ФСГ | 650 руб. |
| ФСГ (CITO) | 950 руб. |
| ФСГ (express) | 650 руб. |
Гормоны задней доли гипофиза
Какие гормоны образуются в задней доле гипофиза и для чего они необходимы? Часто встречается мнение, что задняя доля гипофиза выделяет гормоны вазопрессин и окситоцин, влияющие на многие процессы в организме. Однако, это не совсем правильно.
На самом деле, гормоны задней доли гипофиза образуются в гипоталамусе, а именно в супраоптических и суправентрикулярных ядрах, а затем по специальным путям – аксонам – поступают в нейрогипофиз.
Ранее считалось, что гормонами задней доли гипофиза являются окситоцин, вазопрессин, а также антидиуретический гормон, который считался отличным от вазопрессина. Позднее было доказано, что антидиуретический гормон, или адиуректин, и вазопрессин – одно и то же вещество.
В задний отдел гипофиза, накапливающий гормоны, они поступают по аксонным путям благодаря специфическому транспортному белку – нейрофизину. Далее в нейрогипофизе происходит депонирование гормонов и выделение их в кровь по необходимости.
Гормоны передней и задней доли гипофиза способны взаимно влиять на функции друг друга. Так, вазопрессин способствует усилению секреции некоторых тропных гормонов гипофиза, таких как соматотропин, тиреотропин, кортикотропин, а также стимулирует образование кортизола и инсулина. Важно также отметить влияние на синтез факторов свертывания – фактора Виллебранда и антигемофильного глобулина А, стимуляцию гликогенолиза в печени, а также влияние на снижение температуры тела.
Вазопрессин и окситоцин могут взаимно влиять на функции друг друга и совместно способствуют стимуляции мозговой активности.
Также задняя доля гипофиза выделяет гормоны, функции которых схожи с гипоталамическими гормонами, однако выражены в значительно меньшей степени. К ним относятся изотоцин, валитоцин, мезотоцин и некоторые другие.
Окситоцин
Окситоцин – гормон гипофиза, который вырабатывается ядрами гипоталамуса и затем накапливается в задней доле гипофиза. Это биологически активное вещество вырабатывается как в женском, так и в мужском организме.
Функции окситоцина помимо влияния на физиологию человека, заключаются и во влиянии на его психологическое состояние и некоторые психические функции.
Считается, что этот гормон отвечает за эмоциональную привязанность, укрепление эмоциональных связей между людьми. Доказано, что чем выше концентрация окситоцина, тем более сильные привязанности формируются у человека к своему партнеру, матери, ребенку. Поэтому считается, что окситоцин – гормон привязанности. при этом окситоцин также помогает в социальной адаптации, и препараты с содержанием окситоцина используют при лечении аутизма.
Также повышение уровня окситоцина сопряжено с усиление полового возбуждения, сексуального поведения. Например, если происходят объятия, гормон окситоцин усиливает сексуальное желание партнеров, как и во время поцелуев, телесной близости. При этом повышается настроение, появляется романтический настрой. Поэтому есть еще одно предположение: окситоцин – гормон любви.
Окситоцин снижает воздействие стресса на организм. При выработке гормона в достаточном количестве улучшаются адаптационные возможности организма, уменьшается беспокойство, чувство страха, уровень тревожности. Также усиливается эмоциональная память, формируются более яркие воспоминания. Из-за этого считают, что окситоцин – гормон счастья. Также окситоцин способствует уменьшению тяги к курению, алкоголю, наркотикам. Это свойство широко используется при лечении синдрома абстиненции, в терапии наркозависимости, алкоголизма.
Однако функции окситоцина не ограничиваются только влиянием на психическую сферу. Влияние окситоцина на организм, особенно на женский, незаменимо для регуляции родовой деятельности, выделения грудного молока.
Зачем вырабатывается окситоцин (гормон), функции его в организме:
- У женщин: при родах стимулирует сократительную активность миометрия; стимулирует сокращение матки в первые часы после родов; при грудном вскармливании стимулирует сокращение миоэпителиальных клеток молочных желез, в результате чего молоко поступает из альвеол в выводные протоки, и становится возможной лактация; вызывает лютеолиз желтого тела во втором триместре беременности; стимулирует секрецию пролактина.
- Как гастроинтестинальный гормон: стимулирует электрическую и двигательную активность мышечных клеток тонкого кишечника.
- Оказывает жаропонижающее действие за счет торможения секреции эндогенного пирогена в мононуклеарах.
- Участвует в формировании чувства жажды и в регуляции пищевого поведения.
- Предположительно является антагонистов вазопрессина.
- Уменьшает солевой аппетит.
- Стимулирует клеточный иммунитет.
- Оказывает инсулиноподобное действие на жировую ткань.
Чаще всего окситоцин в виде лекарственного препарата применяется в акушерской практике. Гормон окситоцин вырабатывается и в мужском организме, однако иногда используется его искусственное введение и мужчинам. Преимущественно его используют спортсмены для более быстрого восстановления мышц после интенсивной тренировки, заживления ран, омоложения, повышения настроения. Однако избыточное количество окситоцина неблагоприятно воздействует на мужской организм – снижается половое влечение, развивается импотенция.
Как выработать гормон окситоцин естественным образом? Поскольку это гормон привязанности, любви, счастья, то его концентрация повышается при позитивных эмоциях, отдыхе, объятиях, телесном контакте с приятным человеком, общению с любимыми людьми, массаже, прикосновениях. Хорошо влияют на секрецию пролактина взаимодействия человека в социуме, подкрепленные положительными эмоциями – занятия спортом, танцами, прогулки. Большой пик выброса гормона отмечают у женщин сразу после родов и при прикладывании новорожденного к груди – это помогает забыть родовые муки и сформировать сильную привязанность к ребенку. Кстати, одним из интересных фактов является то, что окситоцин в большей степени вырабатывается ночью и поэтому чаще всего именно в ночное время у беременных появляются схватки – и тренировочные, и родовые.
Также важно знать, анализируя окситоцин, какой гормон регулирует его выработку. Основное влияние на секрецию окситоцина оказывают эстрогены. Секреция окситоцина возрастает перед овуляцией, при родах в период раскрытия шейки матки, при грудном кормлении, при половом акте. Увеличение секреции гормона происходит при повышении осмотического давления окружающей среды, а уменьшение выработки происходит при сильной боли, повышении температуры тела, при воздействии громких звуков.
Зная, на что воздействует гормон окситоцин, за что отвечает в норме, нужно знать и причины его патологического снижения:
- в период менопаузы, особенно при патологическом течении климактерического периода;
- при патологии щитовидной железы;
- при хроническом стрессе;
- вирусных инфекциях;
- инфекционных заболеваниях нервной системы, в частности, головного мозга;
- аутизме;
- болезни Паркинсона;
- наркозависимости;
- в пожилом возрасте.
Последствия дефицита окситоцина могут быть весьма плачевны: патологическое течение родов, гипотонические послеродовые кровотечения, нарушения лактации, послеродовые депрессии и психозы, нарушение формирования материнского инстинкта и чувства привязанности к ребенку, депрессивные состояния, сексуальная дисфункция, ухудшение общего самочувствия, озлобленность, раздражительность, чувство опустошения, недоверия ко всем окружающим.
Поэтому нужно обеспечить для себя максимально комфортные условия для поддержания уровня окситоцина на должном уровне: помогут расслабляющий массаж, путешествия, положительные эмоции, прогулки, общение с приятными людьми, занятия любимым делом.
Вазопрессин
Вазопрессин или антидиуретический гормон (АДГ) — это гормон, который вырабатывается в виде прогормона в гипоталамусе, затем переносится в нервные окончания задней доли гипофиза, из которых секретируется в кровоток при соответствующей стимуляции. Данный гормон в своем составе содержит девять аминокислот, одной из которых является аргинин. Поэтому данный гормон еще называют АДГ.
За что отвечает гормон вазопрессин? Действие гормона вазопрессин основано на выполнении в организме 2 основных функций – регуляция водного обмена и влияние на артериальное давление. Антидиуретическое действие заключается в стимуляции процессов реабсорбции воды в дистальных отделах нефрона, благодаря воздействию на специфические рецепторы второго типа. В результате этого происходит уменьшение экскреции жидкости и увеличение объема циркулирующей крови. Таким образом, одним из эффектов АДГ является уменьшение количества и увеличение концентрации мочи. Также данный гормон увеличивает всасывание воды в кишечнике. Помимо этого, в несколько больших концентрациях вазопрессин способствует повышению тонуса сосудов, вызывая сужение артериол, в результате чего повышается артериальное давление. Это качество гормона чрезвычайно в адаптационных механизмах при большой кровопотере и развитии шока, когда происходит резкий значительный выброс антидиуретического гормона в кровь и сужаются сосуды. Также выделение вазопрессина усиливается при сгущении крови, уменьшении объема внутри- и внеклеточной жидкости, общем обезвоживании, падении артериального давления, активации симпато-адреналовой системы и ренинангиотензиновой системы. Помимо этого, АДГ участвует в формировании чувства жажды, питьевого поведения.
Вазопрессин и альдостерон работают вместе и влияют на обмен жидкости и солей в организме. Альдостерон и вазопрессин и их нарушение может стать причиной алкалоза, ацидоза, отеков.
Как нейропептид, вазопрессин участвует в формировании долговременной памяти, облегчает консолидацию и восстановление памяти, участвует в формировании биологических ритмов, в формировании эмоционального поведения, а также в антиноцицептивной, то есть противоболевой, системе.
При недостаточном количестве вазопрессина развивается такое заболевание, как несахарный диабет. При этом выделяется чрезмерное количество мочи с низкой плотностью. Количество выделяемой жидкости может достигать 25 литров в сутки, вызывая тяжелое обезвоживание организма. Среди причин этого заболевания рассматривают нейроинфекции, черепно-мозговые травмы, опухоли гипоталамуса, мозговые инсульты в гипоталамической области.
При чрезмерном количестве вазопрессина, напротив, экскреция мочи значительно уменьшается, вода задерживается в организме. Это заболевание называется синдром Пархона и встречается крайне редко. Таких больных беспокоят мучительные головные боли, повышенная слабость, отсутствие аппетита, тошнота и рвота, набор массы тела.
Стоит учитывать, что уровень гормона вазопрессина в положении лежа снижается, а в положении сидя и стоя — повышается. Поэтому во время взятия крови на анализ гормона вазопрессин важно учитывать положение пациента.Кроме того, уровень гормона зависит от времени суток (днем концентрация АДГ ниже, чем ночью).
Предназначение гормонов поджелудочной железы
При помощи данного органа обеспечивается эндокринная, а также экзокринная секреция. Причем второй вид секреции ферментов, которые присутствуют в пищеварительном тракте, воспроизводится основной частью поджелудочной железы. Эндокринная функция осуществляется за счет островков Лангерганса – небольших по размеру секретирующих клеток. Их количество не превышает 2% от общего объема железы. Островки состоят из определенных типов клеток. С их помощью происходит выработка следующих важных гормонов:
- при помощи РР-клеток образуется панкреатический полипептид;
- D-клетки необходимы для образования соматостатина;
- В-клетки отвечают за образование инсулина;
- А-клетки необходимы для синтезирования глюкагона.
Роль инсулина
Действие данного биологически активного вещества очень важно для нормальной жизнедеятельности всего организма. С его помощью происходит регулирование в организме уровня глюкозы. В данном процессе участвует большое количество прочих механизмов, также принимающих участие в минимизации глюкозы. Среди них можно выделить следующие:
- Гликолиз или процесс усиленного окисления глюкозы. Данный механизм наблюдается в клетках печени, при взаимодействии ферментов пируваткиназы, глюкокиназы, а также фосфофруктокиназы. Под воздействием инсулина происходит активизация этих веществ. При запуске усиленного расщепления глюкозы, вышеуказанные ферменты будут способствовать снижению ее концентрации.
- Повышение процесса проницаемости глюкозы в клеточных оболочках. В данном случае в мембранах клеток происходит активация специальных рецепторов. Причем данный эффект достигается не за счет усиления их работы, а за счет увеличения количества этих рецепторов.
- Глюконеогенез или подавление процесса превращения определенных веществ в глюкозу. В этом случае действие направлено на подавление инсулином некоторых ферментов. Процесс глюконеогенеза протекает в клетках печени. Там, при участии вазопрессина, ангиотензина, кортикоидных гормонов, а также глюкагона происходит процесс выработки глюкозы, продуцируемой из компонентов неуглеводного характера. В данном случае происходит не только угнетение инсулином вышеуказанных биологически активных веществ, но и одновременное снижение активности фермента печени, играющего главную роль в синтезировании глюкозы.
- Увеличение количества глюкозы, содержащейся в виде гликогена, достигается при помощи глюкозо-6-фосфата. Данный процесс наблюдается в мышечной ткани, а также в клетках печени.
Кроме вышеуказанных процессов, происходит активизация следующих процессов:
- Усиливается пролиферация клеток.
- Увеличивается поглощение клетками белков. Этот процесс является достаточно важным для клеток мышц, нуждающихся в аминокислотах.
- Усиливается процесс преобразования углеводов в жиры. В дальнейшем, инсулин будет содействовать поступлению определенных ферментов к этой жировой ткани. С их помощью будет выстраиваться подкожный жировой слой. Эти отложения могут быть сосредоточены как в подкожной клетчатке, так и на различных органах.
- Происходит стимулирование образования в клетках белков, а также ДНК. Под воздействием инсулина происходит замедление процесса распада данных веществ.
- Повышается процесс проницаемости клеточных стенок для фосфатов, магния, а также калия.
Однако наряду с вышеописанными процессами, происходят и противоположные действия:
- Заметно снижается уровень липолиза. При нем не происходит достаточного расщепления жиров, необходимого для дальнейшей абсорбции этих компонентов в кровь.
- Понижается уровень гидролиза белков. В данном случае наблюдается снижение поступления расщепленных белковых частиц в кровь.
Роль глюкагона
Это биологически активное вещество противоположно по действию инсулину. Его образование не ограничено действием А-клеток. Данный гормон способны воспроизводить также и остальные клетки, сосредоточенные в желудочно-кишечном тракте. Стоит отметить, что 40% этого вещества производится панкреасом. Под воздействием данного гормона в организме происходят следующие процессы:
- Формирование глюкозы из компонентов неуглеродного характера.
- Усиление липидного расщепления, которое происходит при сосредоточении этих соединений в адипоцитах. В данном случае увеличивается количество фермента липазы в жировых клетках, благодаря чему наблюдается последующее поступление составляющих процесса распада жира в кровь. В последующем они могут послужить запасом дополнительной энергии.
- Активирование процесса разложения имеющегося гликогена в мышцах, а также в клетках печени. С его помощью запускается процесс образования глюкозы.
Специалисты утверждают, что данный гормон необходим для запуска механизмов, направленных на увеличение содержания в крови глюкозы. Так как в организме происходит постоянная регуляция различных процессов, противоположное действие данному гормону осуществляет соматостатин. Под его воздействием происходит снижение выработки инсулина. Данное вещество вырабатывается не только в панкреасе, но также и в гипоталамусе. Его активное действие способствует:
- замедленной абсорбции сахаров из продуктов питания;
- угнетению воспроизводства ферментов пищеварения;
- уменьшению количества глюкагона;
- снижению активности выработки соляной кислоты, а также продукции гастрина;
- значительному снижению объема циркулирующей крови в брюшной полости;
- снижению скорости дальнейшего перехода содержимого желудка в кишечник.
Роль панкреатического полипептида
Это вещество, как и продуцирующие его клетки, было обнаружено специалистами в сравнительно недавнем времени. Стоит отметить, что оно вырабатывается только в поджелудочной железе. Влияние данного гормона еще до конца не изучено. Тем не менее ученые отмечают стимулирование его выработки при приеме в пищу жиров, а также глюкозы и белков. При этом введение данных веществ внутривенным путем не способствует его увеличению.
Среди его основных функций специалисты выделяют:
- возможность угнетать действие панкреатических ферментов, участвующих в пищеварении;
- способность к расслаблению мышц желчного пузыря;
- умение приостанавливать выброс билирубина, желчи, а также трипсина.
Действие этого полипептида направлено на экономичное расходование пищеварительных ферментов. Данный гормон осуществляет контроль лишнего расхода желчи, которая необходима для правильного пищеварения. Поэтому можно утверждать, что поджелудочная железа, наряду с ее биологически активными веществами, оказывают огромное влияние на жизненные функции всего организма.
Источник статьи: http://standarts-hormones.ru/gormonyi-zadnej-doli-gipofiza.html


 то есть создает условия для последующего оплодотворения. ЛГ и ФСГ называются гонадотропными, их уровень имеет циклические колебания в женском организме, а у мужчин он определяется постоянной секрецией тестостерона. У детей выделение ЛГ и ФСГ подавлено под действием мелатонина, синтезируемого шишковидной железой.
то есть создает условия для последующего оплодотворения. ЛГ и ФСГ называются гонадотропными, их уровень имеет циклические колебания в женском организме, а у мужчин он определяется постоянной секрецией тестостерона. У детей выделение ЛГ и ФСГ подавлено под действием мелатонина, синтезируемого шишковидной железой.