Цамф как посредник между гормонами
Циклический аденозинмонофосфат (циклический AMФ, 3’5′-цAMФ, 3’5′-cAMP) — органическое соединение, производное АТФ, выполняющее в организме роль вторичного посредника, использующегося для внутриклеточного распространения сигналов некоторых гормонов (например, глюкагона или адреналина), которые не могут проходить через клеточную мембрану.
Содержание
Метаболизм цAMФ [ | ]
3’5′-цAMФ синтезируется аденилатциклазой в ответ на некоторые гормональные стимуляторы; действует как вторичный посредник при клеточном гормональном контроле путём стимуляции протеинкиназ. цАМФ является аллостерическим эффектором протеинкиназ A и ионных каналов. Синтезируется цАМФ мембранными аденилатциклазами (семейство ферментов, катализирующих реакцию циклизации АТФ с образованием цАМФ и неорганического пирофосфата). Расщепление цАМФ с образованием АМФ катализируется фосфодиэстеразами. Ингибируются цАМФ только при высоких концентрациях метилированных производных ксантина, например, кофеина. Аденилатциклазы активируются G-белками (активность которых в свою очередь зависит от метаботропных рецепторов, связанных с G-белками) .
Протеинкиназа А [ | ]
В неактивном состоянии протеинкиназа A является тетрамером, в котором две К (каталитические) субъединицы самоингибированы регуляторными (R) субъединицами. При связывании цAMФ R-субъединицы диссоциируют из комплекса и происходит активация К-субъединиц. Активированная протеинкиназа А фосфорилирует остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах.
цAMФ как вторичный посредник в сигнальной трансдукции [ | ]
цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников (веществ, имеющих короткий период биодеградации) — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путём активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ.
Концентрация цAMФ, образующегося в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цAMФ в тканях животных и человека лежит его взаимодействие с протеинкиназами, например, протеинкиназы А. Связывание цAMФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в том числе ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. цAMФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др.
Роль цАМФ в бактериальных клетках [ | ]
В бактериях уровень цАМФ изменяется в зависимости от среды культивирования. В частности, уровень цАМФ низок, если в качестве источника углерода используется глюкоза. Это регулируется через ингибирование цАМФ-образующего фермента, аденилатциклазы, как побочный продукт транспорта глюкозы в клетку. Транскрипционный фактор CRP (cAMP receptor protein), также называемый CAP (активатный белок генов катаболизма) формирует комплекс с цАМФ и таким образом становится возможным его связывание с ДНК. Комплекс CRP-цАМФ увеличивает экспрессию большого количества генов, включая некоторые ферменты, ответственные за запасание энергии независимо от глюкозы.
цАМФ, к примеру, вовлечен в положительную регуляцию lac оперона. В среде с низкой концентрацией глюкозы, цАМФ накапливается и связывается с аллостерическим сайтом транскрипционного регулятора CRP. Этот белок переходит в активную форму и связывается со специфическим сайтом левее lac промотора, облегчая посадку РНК полимеразы на соседний промотер для старта транскрипции с lac оперона, увеличивая скорость транскрипции lac оперона. При высокой концентрации глюкозы, концентрация цАМФ падает, и CRP диссоциирует из lac оперона.
Источник статьи: http://ru-wiki.ru/wiki/%D0%A6%D0%90%D0%9C%D0%A4
Гормоны увеличивающие концентрацию цамф
Гормоны увеличивающие концентрацию цамф
В последнее время доказано, что циклический аденозинмонофосфат (цАМФ), производное основного источника энергии в организме- АТФ, является важным вторым посредником. Сложная цепь реакций, показанная на рис. 1.15, начинается с рецептора Rs на наружной поверхности плазматической мембраны, который может служить местом специфического связывания для различных медиаторов и гормонов. После связывания со специфической «стимулирующей» молекулой Rs изменяет свою конформацию; эти изменения влияют на белок Gs на внутренней поверхности мембраны таким образом, что становится возможной активация последнего внутриклеточным гуанозинтрифосфатом (ГТФ). Активированный белок Gs, в свою очередь, стимулирует фермент на внутренней поверхности мембраны-аденилатциклазу (АЦ), которая катализирует образование цАМФ из АТФ. Водорастворимый цАМФ и является посредником, передающим эффект стимуляции внеклеточного рецептора Rs к внутренним структурам клетки.
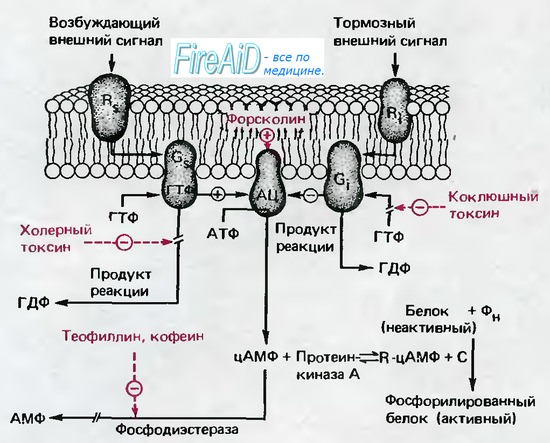
Параллельно со стимуляторной цепью реакций с участием Rs возможно связывание тормозных медиаторов и гормонов с соответствующим рецептором Ri, который опять-таки через ГТФ-активи-руемый белок Gi; ингибирует АЦ и, таким образом, продукцию цАМФ. Диффундируя в клетку, цАМФ реагирует с аденилаткиназой (А-киназа); при этом высвобождается субъединица С, которая катализирует фосфорилирование белка Р. Это фосфорилирование переводит белки в активную форму, и теперь они могут проявить свое специфическое регулирующее действие (например, вызвать деградацию гликогена). Эта сложная регуляторная система чрезвычайно эффективна, так как конечным результатом является фосфорилирование множества белков, т. е. регуляторный сигнал проходит цепь с большим коэффициентом усиления. Наружные медиаторы, которые связываются с рецепторами Rs и Ri, специфическими для каждого из них, чрезвычайно разнообразны. Адреналин, связываясь с Rs или Ri, участвует в регуляции метаболизма липидов и гликогена, а также в усилении сокращения сердечной мышцы и в других реакциях.
Тиреотропный гормон, активируя Rss, стимулирует выделение щитовидной железой гормона тироксина, а простагландин I тормозит агрегацию кровяных пластинок. Ингибиторные эффекты, в том числе адреналина, опосредованные через Ri, выражаются в замедлении липолиза. Таким образом, система цАМФ-это многофункциональная внутриклеточная регуляторная система, которая может точно контролироваться внеклеточными стимуляторными и ингибиторными сигнальными веществами.
Спр. материал / ГОРМОНЫ2 / Аденилатциклазная мессенджерная система
Аденилатциклазная мессенджерная система
В механизме действия ряда гидрофильных гормонов ключевую роль играет вторичный посредник (мессенджер) — циклический АМФ (цАМФ), образующийся из АТФ при участии фермента адени-латциклазы. Различные гормоны увеличивают либо снижают внутриклеточный уровень цАМФ. Например, адреналин резко увеличивает концентрацию цАМФ в мышцах, но относительно мало влияет на печень. Противоположное влияние оказывает глюкагон. Ответ тканей на действие гормонов этой группы осуществляется через уникальные для каждого гормона рецепторы, сопряженные с одним и тем же ферментом — аденилатциклазой. Так, в клетках жировой ткани адреналин, АКТГ, глюкагон, вазопрессин, МСГ стимулируют аденилатцикла-зу и повышают уровень цАМФ. Аденилатциклазная система включает несколько компонентов (рис. 4.6).
При связывании гормона с рецептором коиформация последнего изменяется так, что гормон-рецепторный комплекс связывается с ГТФ-зависимым белком (G-белком) внутри мембраны. Происходит активация G-белка, и он оказывает влияние на аденилатциклазу (актив»рует или ингибирует).
Активная аденилатциклаза, локализованная на внутренней поверхности плазматической мембраны, катализирует образование цАМФ из АТФ в присутствии ионов Mg2+. Образующийся вторичный посредник (цАМФ) является аллостерическим эффектором фермента протеинкиназы, состоящего из четырех субъедиииц: двух регулятор-ных (2R) и двух каталитических (2С).
В ассоциированном состоянии протеинкиназа неактивна. Присоединяя четыре молекулы цАМФ, протеинкиназа диссоциирует на 2R- и 2С-субъедипицы, при этом открывается активный центр каталитической субъединицы. Фермент катализирует фосфорилироваиие ряда белков с образованием фосфопротеинов путем переноса фосфатной группы от АТФ (Mg2+) на остаток серина или треонина в различных белках (более 100 регуляторных белков, в том числе ферментов). В результате фосфорилирования изменяется функциональная активность этих белков (см. рис. 4.6).
Протеинкиназы, зависимые от инсулина и эпидермалыюго фактора роста (ЭФР), уникальны тем, что их ферментативная активность локализована в рецепторе гормона и проявляется при связывании гормона-лиганда с рецептором. Они фосфорилируют преимущественно остатки тирозина.
Протеинкиназы были обнаружены в различных клеточных структурах: клеточной мембране, цитоплазме, рибосомах, ядерной мембране, хроматине. Они могут быть зависимыми от цАМФ или цГМФ, а также от других вторичных посредников.
Действие гормонов, опосредованное увеличением концентрации цАМФ, может быть прекращено путем гидролиза цАМФ фосфоди-эстеразами (см. рис. 4.6). Фосфодиэстеразы циклического АМФ существуют в двух формах (с высокой и низкой Кт) и сами служат объектом регуляции со стороны гормонов, а также внутриклеточных посредников, таких как Са2+-кальмодулиповый комплекс. Ингибиторы фосфодиэстеразы (например, кофеин) увеличивают внутриклеточный уровень цАМФ, тем самым усиливая действие гормонов.
Еще один способ контроля гормонального эффекта — регуляция процесса дефосфорилирования белков под действием фосфопротеин-фосфатаз.
В целом эффект влияния цАМФ на белки обусловлен процессами фосфорилирования — дефосфорилирования белков (ковалентная модификация). Любое воздействие цАМФ, в том числе на такие разные процессы, как метаболизм углеводов и жиров, транспорт ионов, индукция ферментов, рост и деление клеток, может регулироваться активностью специфической протеинкиназы или специфической фосфатазы.
Например, регуляция метаболизма гликогена осуществляется путем изменения активности гликогенсинтазы (неактивна в фосфорилиро-ванной форме, активна в дефосфорилировашюй) и фосфорилазы (неактивна в дефосфорилировашюй форме, активна в фосфорилирован-ной). Повышение концентрации цАМФ приводит к активации фосфорилазы и одновременно к переходу гликогенсиптазы в неактивную форму. Таким образом, при ипгибироваиии гликогенеза усиливается гликогенолиз, а при ипгибировании гликогенолиза — глико-генез
Гормональная регуляция синтеза жира
Основным гормоном, регулирующим липогенез, является инсулин. Инсулин стимулирует синтез жира. На генетическом уровне инсулин стимулирует биосинтез ферментов, катализирующих образование ацил-КоА и триацилглицеринов. Инсулин также стимулирует биосинтез ферментов, обслуживающих обмен липидов – ферментов ГМФ-пути распада углеводов и яблочного фермента. Поэтому истощенным больным вводят глюкозу одновременно с инсулином с целью увеличения жировых запасов.
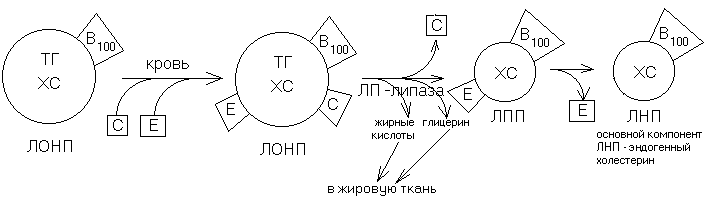
ТРАНСПОРТ ЭНДОГЕННОГО ЖИРА И ХОЛЕСТЕРИНА ИЗ ПЕЧЕНИ В ДРУГИЕ ТКАНИ.
Транспортной формой эндогенного жира и холестерина из печени в другие ткани являются ЛОНП — липопротеины очень низкой плотности. Ядро этих частиц состоит из эндогенных триацилглицеринов и холестерина, а оболочка — из фосфолипидов, белка апоВ100 (образуется в печени, молекулярная масса 100кДа).
Из печени ЛОНП поступают в кровь, где к ним присоединяются белки апоЕ и апоС.
АпоС — активатор липопротеин-липазы капилляров, расщепляет триглицериды, образуются глицерин и жирные кислоты — они поступают в ткань. Затем ЛОНП теряет апоС, превращаясь в ЛПП — липопротеины промежуточной плотности. ЛПП, теряя апоЕ, превращается липопротеины низкой плотности (ЛНП). Он содержит мало триглицеридов и много холестерина. Его функцией является перенос холестерина из печени в ткани.
Рецепторы к В100 были открыты американскими биохимиками Гольдштейном и Брауном. При генетическом дефекте рецепторов к B100 развивается наследственная гиперхолестеринемия, приводящая к раннему атеросклерозу. В этом случае у гомозиготных детей уже в возрасте 5-7 лет наблюдаются множественные инфаркты миокарда. У гетерозигот острые инфаркты миокарда отмечаются в 30-40-летнем возрасте. Если изменяется конформация В100, нарушается взаимодействие лиганда и рецептора. Фактор риска для этой модификации – воздействие на ЛНП компонентов табачного дыма.
Катаболизм жира
Жиры хранятся до момента их использования. Катаболизм жира идет в три этапа:
Гидролиз жира до глицерина и жирных кислот (липолиз)
Превращение глицерина (вступает в ГБФ-путь) и жирных кислот (подвергаются -окислению) в ацетил-КоА.
Общий путь – цикл трикарбоновых кислот
Процесс липолиза известен как МОБИЛИЗАЦИЯ ЖИРА. Мобилизация жира — это реакция гидролиза жира до глицерина и жирных кислот. Это ферментативный процесс. Осуществляют его два фермента:
Ключевым ферментом является липаза жировой ткани. Она регулируется гормонами, поэтому часто ее называют «ГОРМОНЧУВСТВИТЕЛЬНАЯ ЛИПАЗА». Это небольшой белок (мол. масса 82-88 кДа) находится в жировых клетках. Существует в двух формах: фосфорилированной — активной и дефосфорилированной — неактивной. Фосфорилирование липазы происходит под действием протеинкиназы А. Липаза жировой ткани – является цАМФ-зависимым ферментом. Гормоны, увеличивающие концентрацию цАМФ, усиливают липолиз.
Все гормоны, влияющие на мобилизацию жира, можно разделить на 2 группы
Гормоны прямого действия (адреналин, соматотропный гормон гипофиза, инсулин).
Гормоны косвенного действия (глюкокортикостероиды, половые гормоны, лептин).
Мембраны адипоцитов содержат адренорецепторы двух типов ( и ). Взаимодействие адреналина с рецепторами обоих типов вызывает изменение концентрации цАМФ. Однако, это влияние разнонаправленное.
-адренорецептор связан с ингибирующим G-белком (Gi), свызывающим понижение активности аденилатциклазы. Это приводит к уменьшению концентрации цАМФ, и, в конечном счете, торможению липолиза.
-адренорецептор связан со стимулирующим G-белком (Gs) – эффектом будет стимуляция липолиза.
Соотношение - и -адренорецепторов зависит от индивидуальных особенностей организма. Это касается как организма в целом, так и распределения этих рецепторов в разных частях тела – поэтому в процессе липолиза разные части тела у разных людей «худеют» неодинаково. Однако в целом у человека преобладают -адренорецепторы, поэтому суммарное действие адреналина приводит к активации липолиза.
СОМАТОТРОПНЫЙ ГОРМОН – стимулирует липолиз, воздействуя через аденилатциклазную систему.
Действие ИНСУЛИНА связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации.
ГЛЮКОКОРТИКОСТЕРОИДЫ: рецепторы к этим гормонам присутствуют в адипоцитах и содержат в своем составе белки теплового шока. После взаимодействия гормона с рецептором белки теплового шока отделяются, а сам комплекс транспортируется в ядро клетки, где влияет на синтез белков адипоцита. Конкретные механизмы влияния не до конца выяснены и находятся в стадии изучения. В итоге глюкокортикостероиды оказывают двоякое действие: на фоне мышечной работы они стимулируют липолиз, а в состоянии покоя – ингибируют его. Установлено, что при развитии опухоли коры надпочечников или при введении высоких доз препаратов глюкокортикостероидов, наблюдается рост жировых запасов на лице и в верхней части туловища (синдром Иценко-Кушинга).
ПОЛОВЫЕ ГОРМОНЫ: точный механизм их воздействия на жировой обмен пока не выяснен, но известно, что действуют эти гормонов связано со стимуляцией синтеза определенных белков. Действие половых гормонов однонаправленное: стимуляция распада жира. Ярким примером является действие тестостерона. Кастрация приводит к увеличению запасов жира.
ЛЕПТИН (от лат. Leptos– тонкий, худой). По химической природе – полипептид, синтезируется в адипоцитах. Лептин – гормон жировой ткани (поэтому жировую ткань можно отнести к эндокринным). Рецепторы к лептину расположены в гипоталамусе и в тканях репродуктивной системы. Лептин снижает выработку нейропептидаY, который вызывает повышение аппетита и усиливает синтез жира (точные механизмы воздействия пока неясны).Лептин также стимулирует выработку разобщающих белков бурого жира. Суммарный эффект лептина: снижение аппетита и усиление липолиза. Концентрация лептина в крови пропорциональна количеству жировых клеток. Поэтому, можно считать, что лептин передает в головной мозг информацию о количестве жира в организме. Лептин также усиливает репродуктивную функцию человека. В настоящее время ведутся работы над созданием рекомбинантного лептина для лечения ожирения.
Продукты липолиза — глицерин и жирные кислоты выходят из жировой клетки, попадают в кровь и поступают в клетки других тканей. Глицерин как вещество гидрофильное растворяется в плазме крови. Жирные кислоты — гидрофобные вещества. Поэтому для транспорта в кровяном русле для них необходимы переносчики. Транспорт жирных кислот обеспечивают белки плазмы крови альбумины, образующие с ними комплексы. Такие комплексы образуются путем формирования слабых типов связей: гидрофобного взаимодействия радикалов жирных кислот и ионных связей СООН-групп жирных кислот с радикалами лизина молекулы альбумина. Следовательно, жирные кислоты в составе комплекса являются химически свободными. Жирные кислоты, находящиеся в комплексе с альбуминами, обозначаются термином НЕЭСТЕРИФИЦИРОВАННЫЕ ЖИРНЫЕ КИСЛОТЫ (НЭЖК). Уровень НЭЖК в крови – показатель степени мобилизации жира: чем больше в плазме крови НЭЖК, тем интенсивнее идет липолиз.
Липолиз происходит в ходе мышечной работы и при голодании, что сопоровождается повышением концентрации НЭЖК в крови. Глицерин и жирные кислоты в этой ситуации выступают как источники энергии.
Гормоны увеличивающие концентрацию цамф
цAMФ синтезируется аденилатциклазой в ответ на некоторые гормональные стимуляторы; действует как вторичный посредник при клеточном гормональном контроле путем стимуляции протеинкиназ. цАМФ является аллостерическим эффектором протеинкиназ A и ионных каналов. Синтезируется цАМФ мембранными аденилатциклазами (семейство ферментов, катализирующих реакцию циклизации АТФ с образованием цАМФ и неорганического пирофосфата). Расщепление цАМФ с образованием АМФ катализируется фосфодиэстеразами. Ингибируются цАМФ только при высоких концентрациях метилированных производных ксантина, например, кофеина. Аденилатциклазы активируются G-белками (активность которых в свою очередь зависит от метаботропных рецепторов, связанных с G-белками) .
Протеинкиназа А
В неактивном состоянии протеинкиназа A является тетрамером, в котором две К (каталитические) субъединицы самоингибированы регуляторными (R) субъединицами. При связывании цAMФ R-субъединицы диссоциируют из комплекса и происходит активация К-субъединиц. Активированная протеинкиназа А фосфорилирует остатки серина и треонина в более чем 100 различных белках, в том числе во многих ферментах.
цAMФ как вторичный посредник в сигнальной трансдукции
цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников (веществ, имеющих короткий период биодеградации) — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путем активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание cAMP в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ.
Концентрация цAMФ, образующегося в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цAMФ в тканях животных и человека лежит его взаимодействие с протеинкиназами, например, протеинкиназы А. Связывание цAMФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в том числе ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. цAMФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др.
Механизм действия гормонов через рецепторы плазматических мембран
В этом случае гормон не проникает в клетку, а взаимодействует с рецептором на поверхности мембраны. Далее, возможны два варианта событий:
Первый вариант – с рецептором связан фермент, который из специфического субстрата образует второй посредник. Второй посредник далее связывается со своим рецептором в клетке. Чаще всего рецептором посредника является протеинкиназа, которая за счет фосфата АТФ, фосфорилирует белки. В результате изменяются их свойства, возникает биохимический и физиологический эффект.
Второй вариант – рецептор связан не с ферментом мембраны, а с ионным каналом. При связывании гормона с рецептором, канал открывается, ион поступает в клетку и выполняет функции второго посредника.
Хорошо изученными вторыми посредниками являются циклические нуклеотиды (цАМФ, цГМФ) и Ca 2+ .
Механизм действия гормонов через цАмф
Когда соответствующий гормон связывается с рецептором, в мембране активируется фермент аденилатциклаза, который из АТФ образует цАМФ. цАМФ является аллостерическим активатором протеинкиназы, которая фосфорилирует белки и изменяет их свойства. Например, фосфорилирование фосфорилазы приводит к повышению ее активности, а фосфорилирование гликогенсинтетазы – к снижению. цАМФ расщепляется до АМФ фосфодиэстеразой.
Содержание цАМФ в клетке увеличивают: глюкагон, катехоламины (через -рецепторы), антидиуретический гормон, гистамин (Н2-рецепторы), простагландин-Е, простациклин, тиреотропный гормон, АКТГ, холерный токсин.
Содержание цАМФ в клетке снижают: ацетилхолин (М-холинорецепторы), катехоламины (2-рецепторы), соматостатин, ангиотензин-II, опиаты, коклюшный токсин.
Как второй посредник участвует в регуляции:
в нейронах – увеличения возбудимости;
в гладких мышцах – расслабления;
в железах – увеличения секреции;
изменения иммунных реакций;
Механизм действия гормонов через Са 2+
В невозбужденной клетке концентрация кальция 10 -7 М. При возбуждении концентрация кальция возрастает до 10 -6 –10 -5 М. Источниками кальция для этого являются: межклеточная жидкость (содержание кальция – 10 -3 М), эндоплазматический ретикулум (тоже содержание кальция – 10 -3 М).
Когда гормон связывается с рецептором, в мембране открывается кальциевый канал. В результате содержание кальция в клетке возрастает. Кальций связывается с белком клеток – кальмодулином, образуется комплекс, который может действовать непосредственно на белки, вызывая эффекты, или действовать на кальмодулин-зависимую протеинкиназу. Эта протеинкиназа фосфорилирует белки, в результате изменяются их свойства.
Са 2+ в качестве второго посредника выполняет те же функции, что и цАМФ, за исключением того, что в гладких мышцах вызывает сокращение, тромбоцитах – агрегацию.
Содержание кальция в клетке повышают: катехоламины через 1-рецепторы, ацетилхолин через М-холинорецепторы, гистамин через Н1-рецепторы, тромбоксан, ангиотензин-II.
Внутриклеточные гормоны — циклический АМФ (цАМФ)
Sutherland (1970), который открыл биологическую роль этого важнейшего медиатора промежуточного обмена, назвал это соединение вторым посыльным (сигналом), имея ввиду, что гормон является первым сигналом при осуществлении действия на эффекторную ткань.
Гормон, как первый сигнал, транспортируется из эндокринной железы к клеткам ткани-мишени, где он изменяет внутриклеточный уровень цАМФ. Последний выполняет работу гормона внутри клетки; цАМФ обнаружен практически во всех клетках, и до возникновения дифференцированных организмов, как видно, самостоятельно играл роль внутриклеточного первичного гормона.
Вместе с тем возможно, что именно цАМФ действует и вне клетки на уровне ткани, участвуя в механизмах, обеспечивающих морфологически-функциональное единство ткани. К такому выводу приводят данные о том, что контактное торможение клеток, обеспечивающее их взаимодействие в системе ткани, нарушается параллельно уменьшению в клетке цАМФ. Вместе с тем отсутствие контактного торможения является одним из фундаментальных свойств опухолевой клетки.
Фермент аденилциклаза, который катализирует образование цАМФ из АТФ, локализован главным образом в клеточной мембране. Гормоны, которые действуют через цАМФ, стимулируют аденилциклазу, и поэтому был сделан вывод, что рецепторы для этих гормонов функционально связаны с аденилциклазой. Единственным ферментом, который инактивирует цАМФ, является фосфодиэстераза, превращающая цАМФ в 5′-АМФ.
Таким образом, два фактора — аденилциклаза и фосфодиэстераза — играют ключевую роль в поддержании уровня цАМФ в каждой клетке и в организме в целом. Третьим фактором регуляции является скорость поступления цАМФ в экстрацеллюлярную жидкость. Кроме того, ряд факторов — катехоламины, мелатонин, инсулин и особенно простагландины — обладают способностью изменять уровень цАМФ в некоторых клетках.
Кроме медиаторной роли цАМФ в реализации действия ряда гормонов, цАМФ регулирует процесс выделения (а в ряде случаев и синтеза) почти всех гормонов. Таким образом, нередко гормон сскретируется под влиянием цАМФ, а затем и действует через цАМФ. Примером такого механизма является механизм секреции и действия АКТГ и глюкагона.
Ряд данных показывает, что в некоторых случаях гормоны действуют через цАМФ, но более сложным путем, чем непосредственный механизм стимуляции аденилциклазы.
Количество эффектов, реализуемых через действие цАМФ, значительно больше, чем представлено в таблице, причем по мере изучения этой проблемы открываются все новые и новые свойства данного механизма. Так, в частности, недавно было показано, что цАМФ восстанавливает контактное торможение роста фибробластов, трансформированных вирусом полиомы.
Значительный интерес представляло бы выяснение механизма действия цАМФ, однако вряд ли он всегда единообразен.
Следует учитывать, что, кроме цАМФ, во многих тканях обнаружен гуанозин 3′, 5′-монофосфат (циклический ГМФ) и, как предполагает Sutherland, его действие может отличаться от влияния, осуществляемого через цАМФ.
Так, в частности, было показано, что цГМФ стимулирует деление клеток. Несмотря на то, что оба этих нуклеотида оперируют внутри клетки, они в измеримых количествах могут быть определены в крови и моче. Концентрация цАМФ в плазме очень низка, будучи обычно в пределах величин 10 -8 М.
Главный источник циркулирующего цАМФ не ясен, но привлекают внимание данные, что при введении человеку глюкагона происходит чрезвычайно значительное (в ряде случаев в 30 раз) повышение уровня цАМФ. Введение катехоламинов и кальцитонина также вызывает повышение концентрации этого регулятора.
В норме значительное количество цАМФ экскретируется с мочой (в пределах 2-9 мкмоль (0,65-3 мг/сутки). Меньшая часть цАМФ фильтруется из плазмы, большая часть имеет почечное происхождение.
Как видно, паратиреоидный гормон играет важную роль в регуляции почечного цАМФ, так как при введении этого гормона выделение цАМФ с мочой резко возрастает. С другой стороны, инфузия кальция приводит к снижению экскреции цАМФ; цГМФ также выделяется с мочой в относительно высокой концентрации, в количестве до 30% от выделения цАМФ. Инфузия кальция и паратиреоидина повышает концентрацию цГМФ. Ацетилхолин повышает уровень цГМФ и снижает уровень цАМФ, и поэтому можно думать, что оба нуклеотида играют регулирующую и независимую роль во внутриклеточном обмене.
Кроме контроля, оказываемого гормонами, регуляция цАМФ в организме осуществляется, как видно, в значительной мере через адренергические системы, причем β-адренергические стимулы увеличивают концентрацию цАМФ в крови и выделение его с мочой.
Кроме того, уровень цАМФ зависит от активности фосфодиэстеразы, которая разрушает этот субстрат. Теофиллин и некоторые другие ксантиновые производные, а также папаверин ингибируют действие этого фермента и поэтому увеличивают эффекты, связанные с действием цАМФ в организме. Активность аденилциклазы повышают многие гормоны, простагландины, соли магния, что приводит к накоплению цАМФ. С другой стороны, активность аденилциклазы снижается под влиянием никотиновой кислоты и простагландинов, а имидазол и соли магния повышают активность фосфодиэстеразы, что уменьшает концентрацию цАМФ.
Таким образом, цАМФ является медиатором эффектов очень многих гормонов и в свою очередь регулирует выделение большинства, если не всех, гормонов. В физиологических условиях, как видно, не только фосфодиэстераза, но и простагландины являются регуляторами действия цАМФ. Во многих случаях накопление простагландинов в клетке стимулируется теми же гормонами, которые стимулируют накопление цАМФ.
Вместе с тем ряд данных показывает, что именно простагландины в первую очередь подавляют накопление цАМФ, осуществляя тем самым саморегуляцию протогормонов на клеточном уровне.
Система цАМФ
Через систему цАМФ действуют амины,пептиды и белки, а также ПГ I2 и Е2; запах и вкус, т.е типичные внешние сигналы, которые воспринимаются не гормональными рецепторами, а рецепторами органов чувств. Гормон на наружной стороне мембраны связывается со своим рецептором, который сопряжен с G-белком. Дальше сигнал передается на эффекторный белок – аденилилциклазу (АЦ), расположенную на внутренней стороне мембраны. Она активируется и катализирует образование цАМФ из АТФ. Далее цАМФ активирует ферментпротеинкиназуА(ПКА). Она фосфорилирует белки. Активность фосфорилированного белка меняется: либо увеличивается, либо уменьшается. Возвращение белка в исходное состояние происходит при участии ферментов протеинфосфатаз. ПКА состоит из регуляторных и каталитических субъединиц, при этом регуляторные субъединицы угнетают каталитические. При действии цАМФ фермент диссоциирует, каталитические субъединицы растормаживаются и фосфорилируют белки, меняя их активность (например, при фосфорилировании возрастает активность киназы фосфорилазы – ключевого фермента распада гликогена). С другой стороны, фосфорилирование не всегда приводит к активации, например,синтез гликогена тормозится (инактивируется фермент синтеза гликогена – гликогенсинтаза).
Амины, пептиды, белки, ПГ I2 и Е2, запах, вкус увеличивают концентрацию цАМФ. А такие гормоны как КА (через α2-рецепторы), дофамин (D2-рецепторы), ГАМК (ГАМКВ-рецепторы), аденозин (А1-рецепторы), опиоиды, соматостатин, снижают количество цАМФ. Это достигается тем, что первая группа гормонов вовлекает в работу Gs-стимулирующийG-белок. Наоборот, вторая группа гормонов действует через Gi-белок (ингибирующий), который тормозит АЦ и снижает концентрацию цАМФ. Т.о., регуляция АЦ является двойственной, в результате концентрация цАМФ может, как увеличиваться, так и снижаться.
Некоторые бактериальные токсины используют эти механизмы. Холерный вибрион выделяет токсин, который в энтероцитах взаимодействует с Gs-белком и необратимо его активирует, в результате необратимо активируется АЦ, т.е. она начинает работать безостановочно, нарабатывая слишком много цАМФ. Это приводит к накоплению в просвете кишечника солей и воды и вызывает понос. В результате возникает обезвоживание и обессоливание организма, опасное для жизни. Коклюшный токсин действует иначе: связывается с Gi-белком и инактивирует его, вызывая накопление цАМФ. Холерный и коклюшный токсины нарушают регуляцию АЦ вследствие АДФ-рибозилирования G-белков. Коклюшный и сибиреязвенный токсины содержат растворимую АЦ (фактор отека), образуемый ею цАМФ может вызывать интоксикацию.
цАМФ разрушается при действии фермента ФДЭ, который переводит 3′,5′-АМФ в 5′-АМФ. Ингибиторы ФДЭ вызывают накопление цАМФ. Так действуют некоторые негликозидные кардиотоники (милренон). Цилостазол – антитромбическое, сосудорасширяющее, антимитогенное и кардиотоническое средство. Ингибиторы ФДЭ цикло- и пикламиласт расслабляют бронхи и,кроме того, обладают противовоспалительным действием. Они полезны и при хронической обструктивной болезни легких и ревматоидном артрите.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Увлечёшься девушкой-вырастут хвосты, займёшься учебой-вырастут рога 9966 — 

А. Увеличивает реабсорбцию фосфатов в почках
Б. Усиливает реабсорбцию ионов кальция в почках
В. Стимулирует гидроксилирование 25-гидроксихолекальциферола в почках
Г. Активирует аденилатциклазу в клетках-мишенях
Д. Усиливает мобилизацию ионов кальция из костей
105. Выберите один неправильный ответ. Кальцитриол:
А. Синтез регулируется паратгормоном
Б. Продукт гидроксилирования кальцидиола
В. Увеличивает в клетках-мишенях концентрацию инозитол 3-фосфата
Г. Секреция гормона зависит от концентрации ионов кальция в крови
Д. Ускоряет поглощение ионов кальция энтероцитами
Установите соответствие.
1. Активируется путем частичного протеолиза
2. Активируется в результате гидроксилирования
3. Проявляет полную биологическую активность в виде С-концевого фрагмента
4. Стимулирует мобилизацию кальция из кости
107. Выберите правильные ответы. Кальцитонин:
А. Активирует аденилатциклазу
Б. Стимулирует задержку ионовнатрия в организме
В. Стимулирует экскрецию кальция почками
Д. Взаимодействует с белкомтранскортином
108. Выберите один правильный ответ. Причиной гиперкальциемии может быть:
Б. Кальцификация мягких тканей
В. Повышенная утомляемость
Г. Образование камней в мочевыхпутях
Д. Повышение секреции паратгормона
109. Выберите правильные ответы. Снижение концентрации ионов кальция в плазме крови вызывает:
А. Увеличение секреции паратгормона
Б. Ускорение деминерализации кости
В. Уменьшение экскреции кальция почками
Г. Увеличение секреции кальцитонина
Д. Задержку фосфатов почками
Установите соответствие.
2. Увеличивает реабсорбцию воды в почках
3. Стимулирует выделениемолока в период лактации
4. Устойчив к действию протеолитических ферментов
111. Выберите один правильный ответ. Концентрация цАМФ:
А. Не зависит от активности фосфодиэстераз
Б. Влияет на процессы фосфорилирования белков
В. Не может влиять на активность фосфодиэстераз
Г. Уменьшается при действии кофеина
Д. Увеличивается, когда G-белок соединен с гуазин трифосфатом
112. Установите соответствие.
Д. Все сигнальные молекулы
1. Взаимодействуют с цитоплазматическими рецепторами
2. Влияют на метаболизм в клетках-мишенях
3. Участвуют в ауто- и паракринной регуляции
113.Выберите один правильный ответ. Циклический аденозинмонофосфат (цАМФ):
А. Образуется изАМФ
В. Снижает активность фосфодиэстеразы
Г. Повышает активность протеинкиназы А
Д. Образуется в клетке под действием гуанилатциклазы
114. Выберите один неправильный ответ. Циклический гуанозинмонофосфат (цГМФ):
А. Активирует фосфодиэстеразу-1
Б. Регулирует активность гуанилатциклазы
В. Повышает активность протеинкиназы G
Г. Образуется из гуанозинтрифосфата (ГТФ)
Д. Может повышать активность Са 2+ -АТФазы
115. Выберите один правильный ответ. Протеинкиназа G:
А. Фермент аденилатциклазной системы
Б. Ингибируется Gрlс-белками
Б. Регулирует активность аденилатциклазы
В. Имеет центр для связывания цАМФ
Г. Фосфорилирует специфические белки по серину (Сер)и треонину (Тре)
Д. Активируется лигандами: фосфатидилсерином, диацилглицеролом,Са 2+
Установите соответствие.
Г. Тирозиновая Протеинкиназа
1. Фосфорилирует белки по тирозину (Тир)
2. Активируется при повышении концентрациицАМФ в клетке
3.Гидролизует ФИФ2 клеточных мембраг
117. Выберите один наиболее полный ответ. Мембранные С-белки участвуют в:
А. Связывании молекулы ГТФ
Б. Передаче сигнала от комплекса лиганд—рецептор к ферментам клеточной мембраны
В. Регуляции активности протеинкиназы А
Г. Активации аденилатциклазы
Д. Ингибировании аденилатциклазы
118. Повышению концентрации цАМФ и ИФ в клетках печени:
А. Возрастание активности протеинкиназы А
Б. Увеличение концентрации Са 2+
В. Активирование протеинкиназа С
Г. Повышение концентрации адреналина в крови
Д. Снижение активности ацетил- КоА-карбоксилазы
119. Установите соответствие.
1. Образуется из пуринового нуклеозидтрифосфата
2. Может в процессе катаболизма превращаться в АТФ или ГТФ
3. Изменяет четвертичную структуру протеинкиназы А
4.Регулирует активность протеинкиназы G
120. Выберите один неправильный ответ. Гормоны:
А. Различаются по механизму передачи сигнала
Б. Образуются в клетках-мишенях
В. Могут менять активность и количество ферментов в клетке
Г. Секретируются в ответ на специфический стимул
Д. Способны избирательно связываться клетками-мишенями
121. Выберите правильные ответы. Либерины:
Б. Взаимодействуют смембранными рецепторами
В. Активируют секрециютропных гормонов
Г. Передают сигнал на рецепторы передней доли гипофиза
Д. Вызывают секрецию инсулина
122. Выберите один правильный ответ. Инозитолтрифосфат:
А. Образуется под действием фосфолипазы а
Б. Активирует фосфолипазу С
В, Активирует протеинкиназу С
Г. Состоит из а-, b-, g-субъединиц
Д. Стимулирует мобилизацию ионов кальция из эндоплазматического ретикулума
123. Выберите правильные ответы. Стероидные гормоны:
А. Проникают в клетки-мишени
Б. Транспортируются по кровеносному руслу в комплексе со специфическими белками
В. Инициируют транскрипцию
Г. Взаимодействуют с хроматином и изменяют скорость транскрипции
Д. Участвуют в процессе трансляции
124. Выберите один неправильный ответ. Пептидные гормоны:
А. Поступают в клетки-мишени из крови
Б. Действуют через специфические рецепторы
В. Действуют в очень низких концентрациях
Г. Секретируются специализированными эндокринными клетками
Д. Имеют короткий период полураспада
125. Выберите один правильный ответ. Все гормоны:
А. Проявляют свои эффекты через взаимодействие с рецепторами
Б. Образуются в передней доле гипофиза
В. Изменяют активность ферментов в клетках-мишенях
Г. Индуцируют синтез ферментов в клетках-мишенях
Д. Регулируют собственный синтез и секрецию по механизму отрицательной обратной связи
126. Выберите правильные ответы. Инсулин:
А. Синтезируется в а-клетках островков Лангерганса
Б. Синтезируется в виде неактивного предшественника
В. Состоит из 2 полипептидных цепей
Г. Превращается в активный гормон путем частичного протеолиза
Д. Секретируется в кровь вместе с С-пептидом
127. Выберите один неправильный ответ. Тиреоидные гормоны:
Б. Синтезируются в составе белка
В. Угнетают катаболические процессы при гипертиреозе
Г. Синтезируются и секретируются при стимуляции тиреотропина
Д. Могут взаимодействовать с ядерными рецепторами, постоянно связанными с ДНК
Выберите утверждение, которое нарушает последовательность событий.
При взаимодействии тиреотропного гормона с рецепторами щитовидной железы происходит:
Б. Йодирование остатков тирозина в тиреоглобулине
В. Образование комплекса с тироксинсвязывающим белком
Г. Конденсация йодированных остатков тирозина
Д. Транспорт йодтиронинов в клетки-мишени
1. Какие ферменты участвуют в реакциях инактивации активных форм кислорода?
2. Какие утверждения правильно описывают фосфатидилхолин?
1. Входит в состав билипидного слоя мембран
2. В его состав входит остаток фосфорной кислоты
3. Является гидрофобным соединением
4. Накапливается в организме
5. Выполняет энергетическую функцию
3. Какие соединения входят в состав фосфолипидов?
4. Укажите свойства интегральных белков мембран.
1. Содержат неполярный домен
2. Удерживаются в мембране ковалентными связями
3. Являются липопротеидами
4. Содержат большое количество полярных аминокислот
5. Могут выполнять функцию ионных каналов
5. Перемещение липидов перпендикулярно плоскости мембраны называется …
6. Перенос веществ через мембрану по градиенту концентрации – это…
2. первично-активный транспорт
3. вторично-активный транспорт
7. Перенос веществ через мембрану против градиента концентрации – это…
8. Плазматические мембраны клеток разных тканей отличаются:
2. Соотношением глико- и фосфолипидов
5. Содержанием холестерина
10. Механизм передачи сигнала гормона зависит от:
3. Химического строения гормона
5. Внутриклеточного посредника гормона
11. Выберите один неправильный ответ. Мембраны участвуют в:
А. Передаче информации сигнальных молекул
Б. Регуляции метаболизма в клетках
Последнее изменение этой страницы: 2016-08-26; Нарушение авторского права страницы
Источник статьи: http://mupvirc.ru/gormony/gormony-uvelichivayuschie-kontsentratsiyu-tsamf/